-
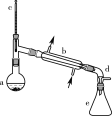
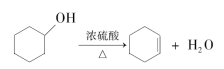
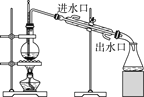
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图。
可能用到的有关数据如下:
| 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是______________。
(2)加入碎瓷片的作用是__________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_____ (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的_______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号)。
A.41% B.50% C.61% D.70%
-
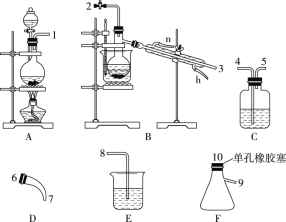
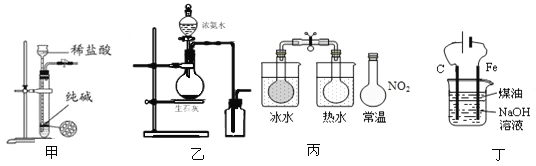
氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用如图所示的装置制备NCl3,并探究NCl3的漂白性。NCl3的相关性质如下:
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40 ℃,沸点为 71 ℃,不溶于冷水,易溶于有机溶剂,密度为 1.65 g·mL-1 | Cl2与NH4Cl水溶液在低温下反应 | 95 ℃ 爆炸,热水中发生水解 |
回答下列问题:
(1)根据实验目的,接口连接的顺序为1-________-________-2-3-6-7-________-________-____。
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为____________________。
(3)A装置中发生反应的离子方程式为_________________________________________。
(4)B装置中发生反应的化学方程式为___________________________________,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 __________________。
(5)当E装置的锥形瓶内有黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,不褪色;若取该液体滴入热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,先变蓝后褪色,结合反应方程式解释该现象: _____________________________________________________________。
-
海洋植物如海带中含有丰富的碘元素,碘元素以I-的形式存在。实验室从海带中提取碘的流程如图所示:
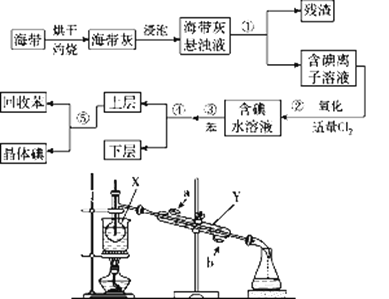
(1)指出提碘的过程中有关的实验操作名称:①________,③________,④________。
(2)操作③、④可以分解为如下几步:
A.旋开活塞,用烧杯盛接溶液
B.从分液漏斗上口倒出上层溶液
C.打开分液漏斗上口玻璃塞或使塞上的凹槽对准漏斗上口的小孔
D.静置,分层 E.把盛有溶液的分液漏斗放在铁架台的铁圈上
F.把 50 mL 碘水和 15 mL 苯加入分液漏斗中,盖好玻璃塞
G.检查分液漏斗是否漏液 H.倒转分液漏斗,振荡
(ⅰ)正确的操作顺序是:G→________→________E→D→________→________→B。
(ⅱ)能选用苯作萃取剂的原因是_____________________________________。
(ⅲ)上述(C)这样操作的目的是________________________________________。
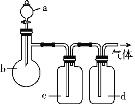
(3)流程图中,将操作④后的________层液体(填“上”或“下”)用上图仪器进行操作⑤,写出仪器的名称:X_______、Y___________。请指出上图装置中存在的一处错误:_____________。
-
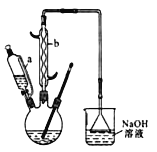
己二酸( )是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
)是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
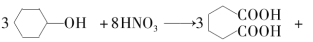 8NO↑+7H2O
8NO↑+7H2O
可能用到的有关数据如下:
| 物质 | 密度(20 ℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962 g·cm-3 | 25.9 ℃ | 160.8 ℃ | 20 ℃ 时水中溶解度 3.6 g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36 g·cm-3 | 152 ℃ | 337.5 ℃ | 在水中的溶解度:15 ℃ 时1.44 g,25 ℃ 时 2.3 g,易溶于乙醇,不溶于苯 | 146 |
实验步骤如下:Ⅰ.在三口烧瓶中加入 16 mL 50%的硝酸(密度为 1.31 g·cm-3),再加入1~2粒沸石,滴液漏斗中盛放有 5.4 mL 环己醇。Ⅱ.水浴加热三口烧瓶至 50 ℃ 左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60~65 ℃ 之间。Ⅲ.当环己醇全部加入后,将混合物用80~90 ℃ 水浴加热约 10 min(注意控制温度),直至无红棕色气体生成为止。Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。Ⅴ.粗产品经提纯后称重为 5.7 g。
请回答下列问题:
(1)仪器b的名称为___________________________________________________。
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则,可能造成较严重的后果,试列举一条可能产生的后果:_______________________。
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为2NO2+2NaOH===NaNO2+NaNO3+H2O,NO+NO2+2NaOH===2NaNO2+H2O。如果改用纯碱溶液,吸收尾气时也能发生类似反应,则相关反应方程式为________ 、_____________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________ 法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
N2O4(g)是放热反应




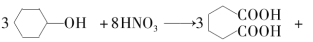 8NO↑+7H2O
8NO↑+7H2O