-
在N2+3H2
2NH3的反应中,经过一段时间后,H2的浓度减少了0.6 mol·L-1。在此段时间内用NH3表示的平均反应速率为0.4 mol·L-1·s-1,则反应所经过的时间是( )
A. 0.44 s B. 1 s C. 1.33 s D. 2 s
难度: 简单查看答案及解析
-
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数如表所示:下列有关叙述不正确的是( )
t/℃
700
800
830
1 000
1 200
K
1.67
1.11
1.00
0.60
0.38
A. 该反应的化学方程式是CO(g)+H2O(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol,则该反应达到平衡状态
D. 若平衡浓度符合下列关系式:
=
,则此时的温度为1 000 ℃
难度: 中等查看答案及解析
-
利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O
 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
2HCOOH+O2,装置如图所示,下列说法不正确的是( )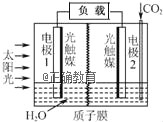
A. 电子由电极1经过负载流向电极2
B. 若将质子膜换成阴离子交换膜,该电池依然能够正常工作
C. 电极2的反应式:CO2+2H++2e﹣=HCOOH
D. 该装置能将太阳能转化为化学能和电能
难度: 中等查看答案及解析
-
化学反应4A(s)+3B(g)⇌2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的表示正确的是( )
A. 用A表示的反应速率是0.4 mol/L•min)
B. 分别用B、C、D表示的反应速率其比值是3:2:1
C. 2 min末的反应速率用B表示是0.3 mol/(L•min)
D. 2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的
难度: 中等查看答案及解析
-
一定温度下的恒容容器中,发生反应A(s)+2B(g)=当C(g)+D(g),下列能表示该反应已达平衡状态的是( )
A. 2v(B)正=V(D)逆
B. 混合气体的密度保持不变
C. 气体总物质的量不随时间变化而变化
D. 混合气体的压强不随时间变化而变化
难度: 简单查看答案及解析
-
根据碘与氢气反应的热化学方程式下列判断正确的是( )
(i) I2(g)+H2(g)
2HI(g)△H=﹣9.48kJ/mol
(ii) I2(S)+H2(g)
2HI(g)△H=+26.48kJ.
A. 1 mol I2(g)中通入2gH2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 简单查看答案及解析
-
在2A(g) +B(g)
3C(g) +4D(g) 反应中,表示该反应速率最快的是:( )
A. V(A)═0.5mol/(L·S) B. V(B)═0.3 mol/(L·S)
C. V(C)═0.8 mol/(L·S) D. V(D)═1 mol/(L·S)
难度: 简单查看答案及解析
-
已知Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是( )
A. 该反应中旧键断裂需要吸收能量,新键形成需放出能量,所以总能量不变
B. 上述热化学方程式中的ΔH的值与反应物的用量无关
C. 该反应为放热反应
D. 反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
在密闭容器中存在下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g),CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是

A. 平衡状态A与C相比,平衡状态A的c(CO)小
B. 在T2时,若反应处于状态D,则一定有v正<v逆
C. 反应CO(g)+H2O(g)
CO2(g)+H2(g)△H>0
D. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2
难度: 中等查看答案及解析
-
氨硼烷(NH3·BH3) 作为一种非常有前景的储氢材料,近年来日益受到人们的重视。氨硼烷(NH3·BH3) 电池可在常温下工作,装置如下图所示。该电池的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是( )
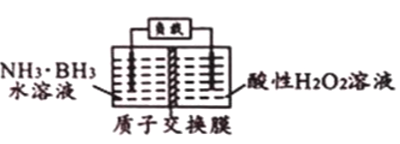
A. 右侧电极发生氧化反应
B. 电池工作时,H+通过质子交换膜向左侧移动
C. 负极的电极反应式为H2O2+2H++2e-=2H2O
D. 每消耗31g氨硼烷,理论上应转移6mol电子
难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示转化关系,且ΔH=ΔH1+ΔH2,则X、Y可能是

①C、CO ②S、SO2③AlCl3、Al(OH)3④Na2CO3、NaHCO3⑤Fe、FeCl2
A. ①②③④⑤ B. ②④⑤
C. ①③④ D. ①②③
难度: 中等查看答案及解析
-
某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g)
2HI(g),反应过程中测定的部分数据见下表(表中t2>t1)。下列说法正确的是
反应时间/min
n(H2)/mol
n(I2)/mol
0
0.9
0.3
t1
0.8
t2
0.2
A. 反应在tmin内的平均速率为:v(H2)=
mol-1·L-1·min-l
B. 保持其他条件不变,向平衡体系中再通0.20molH2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C. 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时 n(HI)=0.2mol
D. 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应
难度: 中等查看答案及解析
-
真空密闭容器中盛有1 mol PCl5,加热到200℃,发生反应PCl5(g)
PCl3(g)+Cl2(g),反应达到平衡后,PCl5所占体积分数为M%。若在同一温度和同一容器中,最初投入2 mol PCl5,反应达到平衡时,PCl5所占体积分数为N%,则M和N的正确关系是 ( )
A. M>N B. M<N
C. M=N D. 无法比较
难度: 简单查看答案及解析
-
通过以下反应均可获取H2。下列有关说法不正确的是 ( )
① 太阳光催化分解水制氢:2H2O(1)=2H2(g)+O2(g) △H1= +571.6kJ/mol
② 焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g)= CO(g)+3H2(g) △H3=+206.1kJ/mol
A. 由反应①知H2的燃烧热为571.6kJ/mol
B. 反应② 中生成物的总能量高于反应物的总能量
C. 反应③ 若改用新催化剂,△H3不变化
D. 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ/mol
难度: 中等查看答案及解析
-
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+ C6
CoO2+ LiC6,下列说法正确的是
A. 充电时,电池的负极反应为 LiC6- e-="=" Li + C6
B. 放电时,电池的正极反应为 CoO2+ Li++ e-="=" LiCoO2
C. 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D. 锂离子电池的比能量(单位质量释放的能量)低
难度: 中等查看答案及解析
-
下列关于化学平衡状态的说法中正确的是( )
A. 改变外界条件不能改变化学平衡状态
B. 当某反应在一定条件下反应物转化率保持不变时即达到了化学平衡状态
C. 当某反应体系中气体的压强不再改变时,该反应一定达到平衡状态
D. 当某反应达到平衡状态时,反应物和生成物的浓度一定相等
难度: 中等查看答案及解析
-
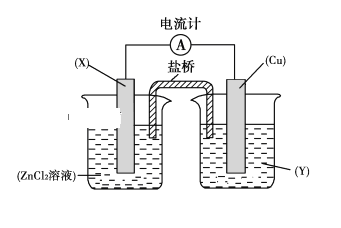
控制适合的条件,将反应
设计成如右图所示的原电池。下列判断不正确的是( )
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上
被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入
固体,乙中的石墨电极为负极
难度: 困难查看答案及解析
-
在一定温度时,N2与H2反应过程中能量变化的曲线如图所示。下列叙述正确的是( )
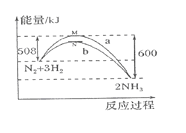
A. 该反应的热化学方程式:N2+3H2
2NH3 ΔH=-92 kJ/mol
B. b曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应放出的热量增多
D. 加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:aA(g)+bB(g)
cC(g),达到平衡后,测得A的浓度为0.5mol・L-1,在温度不变的情况下,将容器的容积扩大到原来的两倍,测得A的浓度为0.3mol・L-1,则下列判断正确的是
A. a+b<c B. C的体积分数下降
C. B的浓度增大 D. A的转化率增大
难度: 困难查看答案及解析
-
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如右上图所示,其中A、B为多孔导电材料。下列说法一定正确的是
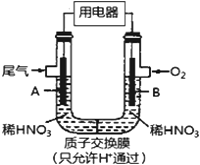
A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ ,NO-3e-+2H2O=NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标况),可以除去含1molNO和NO2的混合尾气
难度: 简单查看答案及解析