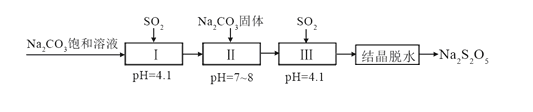
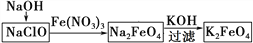-
硫代硫酸钠溶液与氯气能发生反应:Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4,下列说法错误的是
A. 若0.5molNa2S2O3作还原剂,则转移4mol电子
B. 当Na2S2O3过量时,溶液能出现浑浊
C. 氧化产物、还原产物的物质的量之比为1∶1
D. 硫代硫酸钠溶液吸收氯气后,溶液的pH降低
难度: 困难查看答案及解析
-
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO = 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A. NaCl、NaClO B. NaCl、NaClO3 C. NaClO、NaClO3 D. NaClO3、NaClO4
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项正确的是
序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4…
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO4-…
Cl2、Mn2+…
A. 第①组反应中的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1:2
C. 第③组反应中生成1 m0lCl2,转移电子10mol
D. 氧化性由强到弱顺序为Mn04>Cl2>Fe3+>Br2
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是
A. 硫原子的原子结构示意图:
B. 丙烷分子的比例模型:
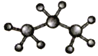
C. 原子核内有10个中子的氧原子:
D. 对氯甲苯的结构简式:
难度: 简单查看答案及解析
-
下列说法正确的是
A. “钴酞菁”的分子(直径为1.3×10-9m)在水中形成的分散系能产生丁达尔效应
B. 铝合金的大量使用归功于工业上用一氧化碳还原氧化铝生产铝
C. 根据溶液导电性强弱,将电解质分为强电解质和弱电解质
D. “地沟油”分馏可制得矿物柴油
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 干冰、液态氯化氢都是电解质
B. Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
C. 有单质参加或生成的反应不一定属于氧化还原反应
D. 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
难度: 中等查看答案及解析
-
下列各项叙述正确的是
①氯水、氨水、水玻璃、水银、福尔马林、淀粉均为混合物
②含有氧元素的化合物叫氧化物
③C02、N02、P205均为酸性氧化物,Na2O、Na2O2为碱性氧化物
④C60 、C70、金刚石、石墨之间互为同素异形体
⑤强电解质溶液的导电能力一定强
⑥在熔化状态下能导电的化合物为离子化合物
A. 全部正确 B. ①②⑤ C. ②③⑥ D. ④⑥
难度: 简单查看答案及解析
-
下列说法正确的是
A. 加入BaCl2溶液,沉淀不溶于盐酸,证明原溶液含有SO42-
B. .Na2O、Na2O2与CO2反应产物相同
C. 小苏打用于治疗胃溃疡病人的胃酸过多症
D. 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数。下列说法中正确的是
A.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA
B.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
C.标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA
D.1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA
难度: 中等查看答案及解析
-
室温下,下列各组离子能大量共存的是( )
A. 稀硫酸中:K+、Mg2+ 、AlO2-、S2O32-
B. NaHS溶液中:SO42-、K+、Cl-、Cu2+
C. Kw/c(H+) =10-13 mol·L-1溶液中:Fe3+、NH4+、Mg2+、SO42-
D. 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
难度: 中等查看答案及解析
-
下列关于有机物的叙述不正确的是
A.C4H8O2的酯有4种结构
B.淀粉和纤维素互为同分异构体
C.乙醇和葡萄糖均能发生酯化反应
D.漂粉精和医用酒精均可用作消毒剂
难度: 简单查看答案及解析
-
下列各物质以不同比例混合后,只能生成一种含钠化合物的是
A、碳酸钠,盐酸 B、氢氧化钠,二氧化碳
C、碳酸氢钠,石灰水 D、过氧化钠,二氧化碳
难度: 简单查看答案及解析
-
下列各反应对应的离子方程式正确的是
A. 硫酸氢钠与氢氧化钡两种溶液反应后溶液恰好呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
C. 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
D. 向含0.1 mol NaOH和0.2molNa2CO3的溶液中加入1L 0.4 mol·L-1稀盐酸:OH-+CO32-+3H+=CO2↑+2H2O
难度: 困难查看答案及解析
-
某白色粉末由两种物质组成,为鉴定其成分进行如下实验:
①取少量样品,加入足量水,仍有部分固体未溶解;过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解;
②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在。该白色粉末可能为
A. Na2SO3、Mg(OH)2 B. Al(OH)3、NaHCO3
C. Na2CO3、CuSO4 D. Ca(HCO3)2、Al(OH)3
难度: 中等查看答案及解析
-
下图为利用海水制备部分物质的过程。下列有关说法正确的是
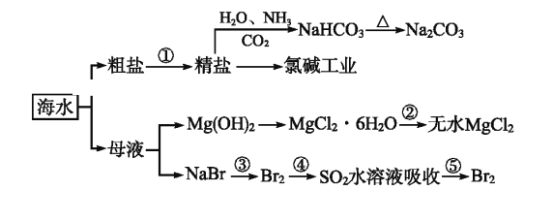
A. 制取NaHCO3的反应是利用其溶解度小于NaCl的溶解度
B. 用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 加热MgCl2溶液制取无水氯化镁
难度: 中等查看答案及解析
-
关于有机物a(
)、b(
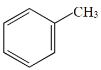 )、c(
)、c( )的说法正确的是
)的说法正确的是A. b、c互为同系物 B. a、b互为同分异构体
C. c分子的所有原子不可能在同一平面上 D. a、b、c均能与溴水反应
难度: 中等查看答案及解析
-
在标准状况下,将a LNH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是 ( )
A. ω=

B. c=
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
将物质的量相等的硫酸铝和硫酸铵溶于水形成V mL混合溶液,向混合溶液中逐滴加入某氢氧化钠溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量.下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )
A.
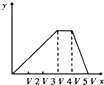 B.
B. 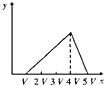
C.
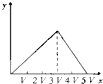 D.
D. 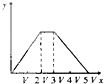
难度: 困难查看答案及解析
-
现有MgSO4和AlCl3混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )

A. 1:6
B. 1:3
C. 6:1
D. 3:1
难度: 中等查看答案及解析