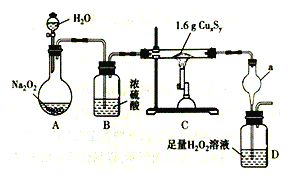
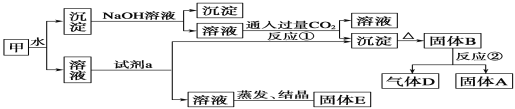
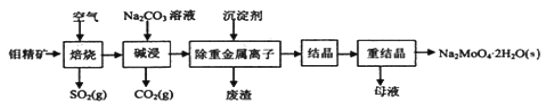
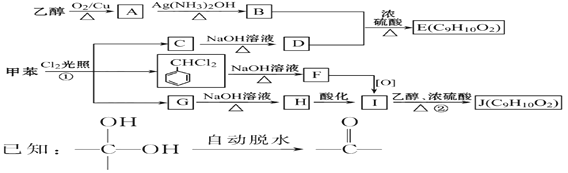
-
硫代硫酸钠溶液与氯气能发生反应:Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4,下列说法错误的是
A. 若0.5molNa2S2O3作还原剂,则转移4mol电子
B. 当Na2S2O3过量时,溶液能出现浑浊
C. 氧化产物、还原产物的物质的量之比为1∶1
D. 硫代硫酸钠溶液吸收氯气后,溶液的pH降低
难度: 困难查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH−
B. 0.1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3−
C. 0.1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+ 、NO3−、SO42−
D. 0.1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. Mg和Al都可以用电解法冶炼得到
B. Na2O和Na2O2与CO2反应产物相同
C. MgO和Al2O3均只能与酸反应,不能与碱反应
D. 根据丁达尔现象可以将分散系分为溶液、胶体和浊液
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
B. pH=1的HCl溶液中,含有0.1 NA个H+
C. 标准状况下 ,22.4 L氯气与足量铁粉充分反应,转移的电子数为3NA
D. 密闭容器中1 moN2与3 mol H2在一定条件反应可制备2moNH3(g)
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是 ( )
A. 将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑
B. 过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
C. 向澄清石灰水中通入过量的碳酸氢钠:Ca2++2OH-+2HCO3-=CaCO₃↓+2H2O+CO32-
D. 将除去氧化膜的铝片加入烧碱溶液中:Al++2H2O=2AlO2-+2H2↑
难度: 中等查看答案及解析
-
下列化学实验对应的现象及结论都正确且两者具有因果关系的是
实验
现象
结论
A
向浓度均为0.1mol/L的NaHCO3溶液和NaHSO3溶液中滴加几滴酚酞试剂
前者溶液变红,后者不变色
NaHCO3水解,而NaHSO3不水解
B
向NaAlO2溶液中通入NH3
白色沉淀
Al(OH)3不能溶解在弱碱中
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中一定有Na+、无K+
D
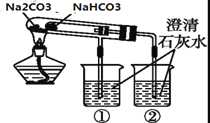
烧杯②澄清石灰水先变浑浊
碳酸氢钠比碳酸钠受热更易分解
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
工业上用铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如下:
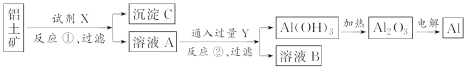
下列叙述正确的是( )
A. 反应①中试剂X是氢氧化钠溶液
B. 试剂Y是HCl,它与AlO
反应生成氢氧化铝
C. 图中所示转化反应中包含2个氧化还原反应
D. 将X与Y试剂进行对换,最终可以达到相同结果
难度: 中等查看答案及解析