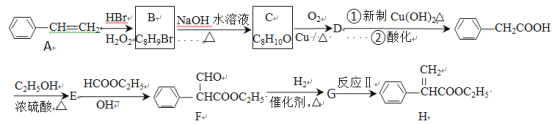
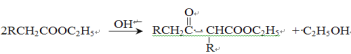-
下列关于有机物的说法中,正确的一组是
①“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
②汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O
③石油的分馏、煤的气化和液化都是物理变化。
④淀粉和纤维素水解的最终产物都是葡萄糖
⑤将ag铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于ag
⑥除去CH4中的少量C2H4,可将混合气体通过盛有溴水的洗气瓶
A. ③⑤⑥ B. ④⑤⑥ C. ①②⑤ D. ②④⑥
难度: 简单查看答案及解析
-
已知常温下,几种物质的电离平衡常数,下列反应的离子方程式正确的有几个
弱酸
HCOOH
HCN
H2CO3
HClO
苯酚
K25℃
K=1.77×10-4
K=4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
K=2.98×10-8
K=1.1×10-10
①向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
②次氯酸钙溶液中通入少量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
③次氯酸钠溶液中通入少量二氧化碳:2C1O-+H2O+CO2=2HClO+CO32-
④次氯酸钠溶液中通入少量二氧化硫:3ClO-+SO2+H2O=SO42-+2HClO+Cl-
⑤纯碱溶液中滴加少量甲酸:2HCOOH+CO32-=2HCOO-+H2O+CO2↑
⑥碳酸钠溶液中通入过量氯气:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
⑦NaCN溶液中通入少量的CO2:CN-+CO2+H2O=HCO3-+HCN
A. 2个 B. 3个 C. 4个 D. 5个
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的有几个
①12.0 g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阳离子总数是3 NA
③常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 NA
④7.8 g
中含有的碳碳双键数目为0.3 NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2 NA个电子
⑦在反应KIO3+6HI=KI+3I2+3H2O 中,每生成3molI2转移的电子数为5 NA
⑧常温常压下,17 g甲基(-CH3)中所含的中子数为9 NA
A. 3 B. 4 C. 5 D. 6
难度: 困难查看答案及解析
-
由下列实验及现象不能得出相应结论的是
选项
实验
现象
结论
A
向2 mL 0.01mol/L的 FeCl3溶液中加入1滴KSCN溶液,再加入足量铁粉,充分振荡
溶液变为红色,加入铁粉后红色褪去,变为浅绿色
Fe3+比Fe2+的氧化性强
B
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
湿润的红色石蕊试纸逐渐变蓝
NH4HCO3分解产生氨气
C
将一小块金属钠放置在空气中,一段时间后,将其放置在坩埚中加热
钠表面变暗,加热时,钠燃烧,发出黄色火焰
钠易与氧气反应,加热时生成Na2O的速率加快
D
向2支盛有2 mL相同浓度银氨溶液的试管中,分别加入2滴相同浓度的NaCl和NaI溶液
一支无明显现象,另一支产生黄色沉淀
相同条件下,AgI比AgCl的溶解度小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某混合溶液中可能含有下列离子中的若干种:K+、Na+、Fe2+、Fe3+、SO42-、I-、CO32-,现取三份20 mL该溶液进行如下实验:①第一份加入足量盐酸,无任何气体产生;②第二份加入足量NaOH溶液,经搅拌、过滤、洗涤、灼烧,最后得到x g固体;③第三份滴加0.10 mol·L-1酸性KMnO4溶液,恰好完全反应,消耗其体积为V mL;④另用洁净的铂丝蘸取该混合溶液置于浅色火焰上灼烧,发现火焰呈现黄色。根据上述实验,以下说法正确的是
A. 由实验②、③可判定原混合溶液中是否存在I-
B. 由实验①可推断原混合溶液中是否含有SO42-
C. 由实验③可判定原混合溶液中是否含有Fe2+
D. 原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32-
难度: 困难查看答案及解析
-
由丁醇(X)制备戊酸(Z)的合成路线如图所示,不正确的是
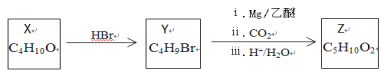
A. Y的结构有4种
B. X、Z能形成戊酸丁酯,戊酸丁酯最多有16种
C. 与X互为同分异构体,且不能与金属钠反应的有机物有4种
D. 与Z互为同分异构体,且能发生水解反应的有机物有9种
难度: 困难查看答案及解析
-
短周期元素a、b、c、d、e 的原子序数依次增大,由它们形成的化合物X、Y、Z、W 在一定条件下的相互转化关系如图所示。已知X、Y、Z均含有d元素;X的焰色反应呈黄色;Y是两性氢氧化物;0.1mol·L-1W溶液的pH为1。下列说法正确的是
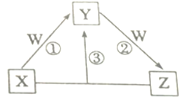
A. e元素的含氧酸的酸性在同主族中最强
B. b元素的单质和氢化物可能具有氧化性和漂白性
C. c与e和a与e元素形成的化合物均属于电解质且化学键类型相同
D. b、c、d元素的离子半径大小顺序是 c>d>b
难度: 困难查看答案及解析
-
相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g)
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol
达平衡时体系能量的变化
容器
X2
Y2
XY3
容器①恒温恒容
1
3
0
放热 23.15 kJ
容器②恒温恒压
1
3
0
Q(Q>0)
下列叙述正确的是
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ
难度: 困难查看答案及解析
-
通过膜电池可除去废水中的乙酸钠和对氯苯酚(
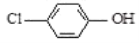 ),其原理如下图所示,下列说法正确的是
),其原理如下图所示,下列说法正确的是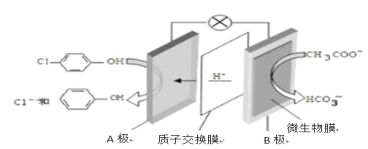
A. B为电池的正极,发生还原反应
B. 电流方向从B极沿导线经小灯泡流向A极
C. A极的电极反应式为:
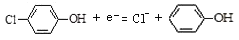
D. 当外电路中有0.2mol e- 转移时,A极区增加的H+ 的数目为0.1NA
难度: 困难查看答案及解析
-
在常温下,0.1000 mol·L-1 Na2CO3溶液25 mL用0.1000 mol·L-1盐酸滴定,滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列说法不正确的是
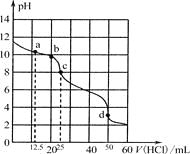
A. a点:c(HCO3-)>c(CO32-)>c(OH-)
B. b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C. c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D. d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
难度: 困难查看答案及解析

 )的关系如图所示。
)的关系如图所示。