-
下列说法中正确的是( )
A. 废旧电池可以随意丢弃 B. 铁矿石可以随意开采
C. 被腐蚀的铁制品应该加以回收利用 D. 铁丝在氧气中燃烧生成氧化铁
难度: 中等查看答案及解析
-
溶液在我们生活中有着广泛的用途。下列物质不属于溶液是的( )
A. 碘酒 B. 澄清的石灰水 C. 生理盐水 D. 酒精
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 钢不属于合金
B. 金刚石和石墨性质完全相同
C. 铁在潮湿的空气中容易生锈
D. 常温下,氧气与所有金属都能反应
难度: 简单查看答案及解析
-
钢铁是使用最多的金属材料,根据你的生活经验分析,下列做法错误的是( )
A. 钢铁放在潮湿的空气中容易生锈
B. 在铁桶中加入硫酸铜、生石灰和水,配制农药
C. 雨水淋湿的自行车,须先用干布擦拭后再用带油的布擦
D. 用铁板可以制作防盗门
难度: 中等查看答案及解析
-
金属是重要的资源.下列有关金属制备的说法错误的是( )
A. “湿法炼铜”的化学原理可以表示为:Fe+CuSO4═FeSO4+Cu
B. 电解氯化镁可以制备金属镁,该反应为分解反应
C. 工业上用一氧化碳还原氧化铁制备铁,该反应属于置换反应
D. 金矿中的金是以单质形式存在,用物理方法可以制得
难度: 中等查看答案及解析
-
哈尔滨西客站的建成促进了城市的发展,提升了哈尔滨铁路运输的能力.下列有关西客站的叙述错误的是( )

A.西客站是我省第一个实现高速铁路客运的现代化枢纽
B.建设过程中使用了大量的纯铁.其硬度大于钢的硬度
C.一些设施中使用的塑料属于合成材料
D.采用了节能照明设备.降低了能源的消耗
难度: 中等查看答案及解析
-
在硝酸银溶液中,加入少量的铁粉,充分反应后过滤,得到的滤液的成分是( )
A. 硝酸银 B. 硝酸铁
C. 硝酸亚铁 D. 硝酸银和硝酸亚铁
难度: 中等查看答案及解析
-
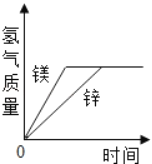
现有铁与另一种金属组成的混合物1.2g,与足量稀硫酸反应生成H2 0.1g,则混合物中的另一种金属可能是( )
A. Mg B. Al C. Zn D. Cu
难度: 困难查看答案及解析
-
某钢样品的含铁量为99.64%,假设该钢样品的组成物质为Fe、Fe2C和Fe3C,则该钢样品Fe2C和Fe3C的质量分数(w)范围是( )
A. 2.48%<w<3.6% B. 0.03%<w<2%
C. 2.24%<w<3.36% D. 3.72%<w<5.40%
难度: 中等查看答案及解析
-
同学们为探究不同金属的活动性强弱,设计了如下实验方案,下列方案中实验设计、现象、结论均正确的一组是( )
选项
实验设计
现象
结论
(金属的活动性)
A
将锌片放入硝酸银溶液
无现象
Ag>Zn
B
分别将锌粉与铁丝放入相同浓度的稀盐酸中
锌粉产生气泡的速度比铁丝快
Zn>Fe
C
分别将铁丝与铜丝放入相同浓度的稀盐酸中
铁丝表面产生气泡,铜丝无现象
Fe>Cu
D
将铝丝放入硫酸镁溶液中
铝丝表面有固体析出
Al>Mg
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 水中有鱼虾生存,是因为氧气易溶于水
B. 可燃物接触氧气就能燃烧
C. 利用洗涤剂的乳化功能去除油污
D. 氧气能和所有的金属反应
难度: 简单查看答案及解析
-
在日常生活中,下列说法或做法正确的是( )
A. 用厨房洗涤剂除去热水瓶中的水垢
B. 常用烧碱溶液清洗衣服上的油漆
C. 常用洗洁精除去餐具上的油污
D. 用向水中加入食盐的方法,给高烧病人降温
难度: 中等查看答案及解析
-
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀,下表中液体X和固体Y的组合,符合题意的是( )
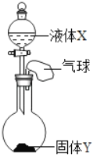
①
②
③
④
X
双氧水
水
水
水
Y
二氧化锰
氯化钠
氢氧化钠
硝酸铵
A. ①② B. ①③ C. ①③④ D. ②③④
难度: 中等查看答案及解析
-
下列关于金属的叙述与金属活动性顺序无关的是( )
A.不用铁制容器配制波尔多液(含有硫酸铜) B.真金不怕火炼
C.用稀硫酸识别黄铜(铜锌合金)假冒的黄金指环 D.铝制品比铁制品更耐腐蚀
难度: 中等查看答案及解析
-
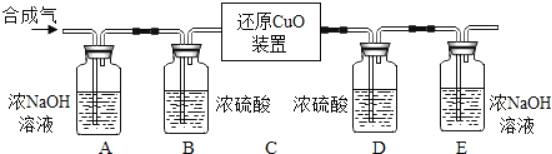
化学实验操作中常涉及“先后”问题,下列操作的先后顺序错误的是( )
A. 制取气体:先检验装置的气密性,后加入药品
B. 点燃可燃性气体:先检验气体的纯度,后点燃
C. CO还原氧化铁实验结束时:先停止通CO,后撤离酒精灯停止加热
D. 除去H2中混有的CO2和H2O,先通过氢氧化钠溶液,后通过浓硫酸
难度: 中等查看答案及解析
-
把一定量的Fe粉放入AgNO3、Cu(NO3)2、Zn(NO3)2混合溶液中,充分反应后过滤,对滤出的固体和滤液中溶质的叙述正确的是( )
A.滤出的固体中含有Ag,滤液中一定含有Cu(NO3)2,Fe(NO3)2,Zn(NO3)2,可能含有AgNO3
B.滤出固体中有Ag,Cu,滤液中一定有Cu(NO3)2,Fe(NO3)2,Zn(NO3)2
C.滤出固体中有Ag,Cu,Fe,滤液中一定有Zn(NO3)2,可能含有Fe(NO3)2
D.滤出的固体中有Ag,Cu,Fe,滤液中一定含有Zn(NO3)2,Fe(NO3)2,可能含有Cu(NO3)2
难度: 中等查看答案及解析