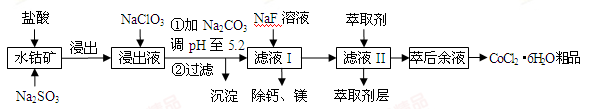
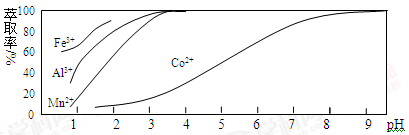
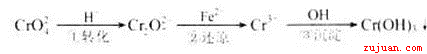-
化学在工农业生产和日常生活中都有重要应用。下列叙述正确的是( )
A. 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物
B. 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质
C. 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜
D. 压缩天然气(CNG)、水煤气的主要成分是烃类,是城市推广的清洁燃料
难度: 中等查看答案及解析
-
下列叙述正确的是:
A. 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去
B. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C. 已知2SO2(g)+ O2(g)
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和KCl溶液中滴加AgNO3溶液,最先生成Ag2CrO4沉淀
难度: 困难查看答案及解析
-
下列叙述正确的是( )
A.
和
均是芳香烃,
既是芳香烃又是芳香化合物
B. 邻二甲苯的一氯取代物有2种
C.
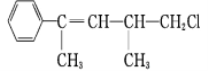 在加热和催化剂作用下,最多能与4 mol H2反应
在加热和催化剂作用下,最多能与4 mol H2反应D. 由乙烯推测丙烯的结构,丙烯分子中所有原子都在同一平面上
难度: 中等查看答案及解析
-
已知:25℃,H2A的电离常数Kl=6.0×10-2,K2=6.0×10-5。此温度下,将1 mL浓度为0.1mol/L, 的H2A溶液加水稀释到1000mL。下列说法正确的是
A. 上述稀释过程中,H2A分子及所有离子浓度均减小
B. 上稀释过程中,
的变化趋势保持增大
C. 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-)
D. 根据H2A的电离常数,可推知0.1mol/L NaHA溶液的pH值大于7
难度: 困难查看答案及解析
-
已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH
HClO
H2CO3
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.4×10-7
Ka2=4.7×10-11
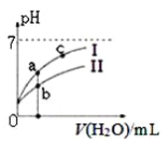
图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:
c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:
2ClO-+CO2+ H2O = 2HClO+CO32-
C. 图像中a、c两点处的溶液中
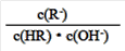 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)D. 图像中a点酸的总浓度大于b点酸的总浓度
难度: 中等查看答案及解析
-
某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )
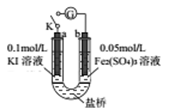
A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
难度: 中等查看答案及解析
-
浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确的是
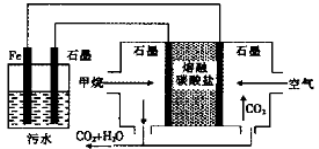
A. 通入甲烷的石墨电极的电极反应式为:CH4+10OH--8e-═CO32-+7H2O
B. 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32-
C. Fe电极的电极反应式为:Fe-2e-═Fe2+
D. 为增强污水的导电能力,可向污水中加入适量工业用食盐
难度: 中等查看答案及解析