-
化学与生活密切相关,下列有关说法错误的是( )
A. 维生素C又称“抗坏血酸”,帮助人体将不易吸收的Fe3+转化为Fe2+
B. “长征九号”运载火箭的壳体通常采用纤维为增强体,金属为基体的复合材料
C. 铁与氯气直接反应而腐蚀,钢管被原油中含硫化合物腐蚀均是发生化学腐蚀
D. 在涂料中尽量用液态有机物代替水作溶剂,以增大溶解度并减少环境污染
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的有( )个
①20℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有NA个电子转移
②64g灼热的铜丝在硫黄蒸气里完全反应后,失去的电子数为2NA
③标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L
④7.8g Na2S与Na2O2的混合物中阴离子数大于0.1NA
⑤0℃,101kPa,含有lmol硫原子的SO2与SO3的混合物,其体积小于22.4L
⑥常温常压下,17g甲基(-14CH3)所含的中子数为9NA
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
下列有关物质结构和性质的说法不正确的是( )
A. 分子式为C5H9O2Cl且能与饱和NaHCO3溶液反应产生气体的有机物有12种(不含立体结构)
B. 已知引发某疫情的病毒对化学药品很敏感,乙醇、漂白粉溶液均可将病毒氧化而达到消毒的目的
C. 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g
D. 按系统命名法,化合物
 的名称为3-甲基-5,7-二乙基癸烷
的名称为3-甲基-5,7-二乙基癸烷难度: 困难查看答案及解析
-
下列实验方案能达到实验目的的是( )
A. 在探究海带灰浸取液成分的实验中,向无色的浸取液中加入CCl4,下层呈无色,说明浸取液中不含碘元素
B. 向溶有CO2的BaCl2溶液中通入气体X,产生白色沉淀,该气体可以是碱性气体
C. 向一定量饱和氯水中通入足量SO2,再通入足量AgNO3,将生成的沉淀过滤洗涤干燥后称量,来测定其中氯元素的含量
D. 已知20℃时溶解度:NaHCO3为9.6 g,Na2CO3为21.8 g,向盛有5mL蒸馏水的两个试管中分别加入10g的 NaHCO3、 Na2CO3,观察溶解情况可以比较该温度下NaHCO3和Na2CO3的溶解度大小
难度: 中等查看答案及解析
-
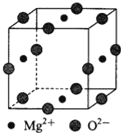
短周期主族元素X、Y、Z、W的原子序数依次减小,其中只有Z为金属元素,X、Y、Z同周期且位于不同奇数族,Z、W同主族,Y、Z的原子序数相差4。下列说法正确的是( )
A. W的简单阴离子半径一定大于Z的简单阳离子半径
B. 非金属性:X>Y,所以X和Y分别对应含氧酸的酸性:X一定强于Y
C. X、 Y形成的单质一定都是双原子分子
D. Z、W形成化合物的电子式为
难度: 中等查看答案及解析
-
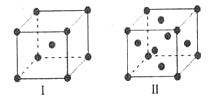
在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
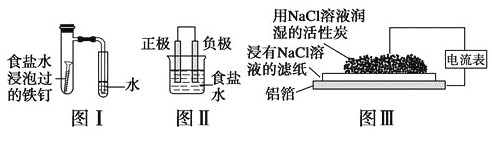
A. 按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B. 图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
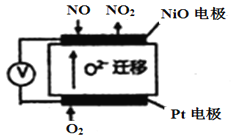
C. 铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D. 图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
难度: 困难查看答案及解析
-
若用AG表示溶液的酸度(acidity grade),AG的定义为AG = lg[
].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL 0.01mol•L-1的一元弱酸HA,滴定过程如图所示,下列叙述正确的是( )
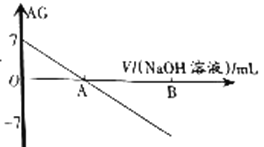
A. 室温下,弱酸HA的电离常数约为10-5
B. A点时加入氢氧化钠溶液的体积为20.00mL
C. 若B点为40mL,所得溶液中:c(OH-) = c(A-)+c(HA)+c(H+)
D. 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(HA)
难度: 困难查看答案及解析
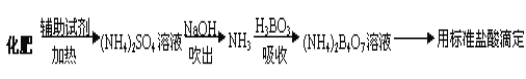
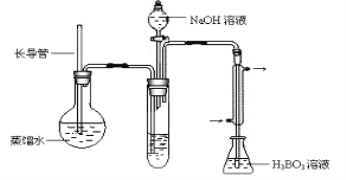

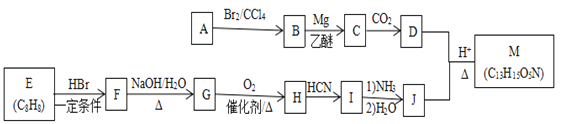
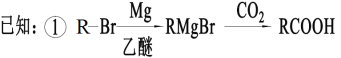
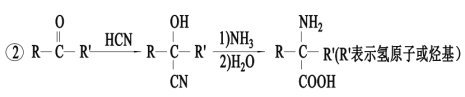
 的合成路线流程图(无机试剂任用)。合成路线流程图示例为:
的合成路线流程图(无机试剂任用)。合成路线流程图示例为: _____________
_____________