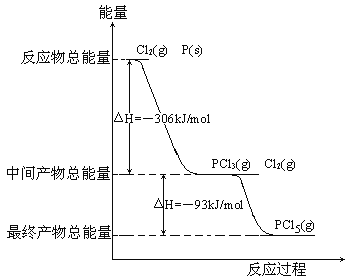
-
下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(−57.3)kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=2×(+283.0 kJ·mol-1)
C. 需要加热才能发生的反应一定是吸热反应
D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
X、Y、Z、M为原子序数依次增大的4种短周期元素。已知X、Y、Z是同周期的相邻元素,M原子的核外电子数是Z原子最外层电子数的2倍,Y与其同主族的短周期元素可形成一种常见的气体。下列说法正确的是
A. 原子半径:M>X>Y>Z
B. 对应氢化物的沸点:M>Z>Y>X
C. 对应氢化物的稳定性:Z>X>Y>M
D. XY2与MY2溶于水都能得到对应的酸
难度: 简单查看答案及解析
-
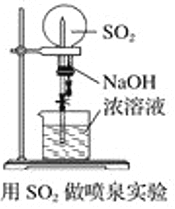
下列实验装置不能达到实验目的的是
A. 用SO2做喷泉实验
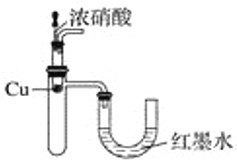
B. 验证Cu与浓硝酸反应的热量变化
C. 验证氨气易溶于水
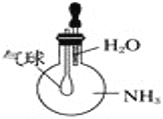
D. 比较Na2CO3、NaHCO3的稳定性
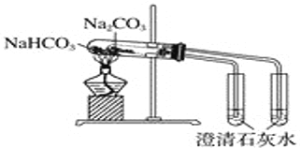
难度: 中等查看答案及解析
-
下表是元素周期表中短周期的一部分。已知A元素原子的最外层电子数比其电子层数的3倍还多。下列关于表中六种元素的说法正确的是 ( )
A. X的单质在空气中可以燃烧
B. X、Y、Z三种元素中Y元素形成的单核阴离子半径最大
C. 最高价氧化物对应的水化物酸性最强的是A元素
D. A单质通入NaZ溶液中,根据反应现象可证明A、Z非金属性的相对强弱
难度: 简单查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
难度: 中等查看答案及解析
-
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是( )
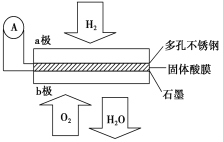
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,消耗1.12 L的H2
D. H+由a极通过固体酸电解质传递到b极
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 放电时正极反应为:FeO42-+4H2O + 3e-=Fe(OH)3+5OH-
C. 放电时每转移3mol电子,正极有1mol K2FeO4被还原
D. 放电时正极附近溶液的pH不变
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 若单位时间内生成x mol NO的同时消耗x mol NH3,则反应达到平衡状态
B. 达到化学平衡时,4v正(O2)=5v逆(NO)
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
难度: 中等查看答案及解析
-
某温度下,在恒容密闭容器中进行反应:X(g)+Y(g
Z(g) + W(s) △H>0。下列叙述正确的是
A. 加入少量W,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡向逆反应方向移动
D. 平衡后,加入X,该反应的△H增大
难度: 中等查看答案及解析