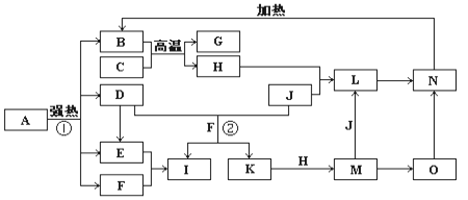
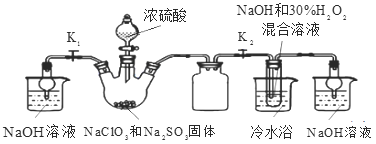
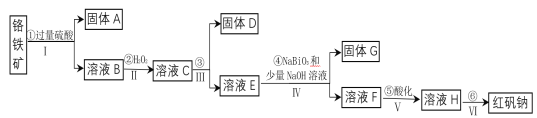
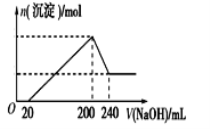
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH−
B. 0.1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+ 、NO3−、SO42−
C. 0.1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3−
D. 0.1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A. 泡沫灭火器可用于一般的起火,也适用于电器起火
B. 疫苗一般应冷藏存放,以避免蛋白质变性
C. 家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D. 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. NaHCO3受热易分解,可用于制胃酸中和剂
B. SiO2熔点高硬度大,可用于制光导纤维
C. Al2O3是两性氧化物,可用作耐高温材料
D. CaO能与水反应,可用作食品干燥剂
难度: 中等查看答案及解析
-
以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是
A. 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应
B. 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
C. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
难度: 中等查看答案及解析
-
下列有关物质性质的比较,结论正确的是
A. 溶解度:Na2CO3<NaHCO3
B. 热稳定性:HCl<PH3
C. 沸点:C2H5SH<C2H5OH
D. 碱性:LiOH<Be(OH)2
难度: 中等查看答案及解析
-
CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨 C. 化石燃料的燃烧 D. 碳酸盐的沉积
难度: 简单查看答案及解析
-
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
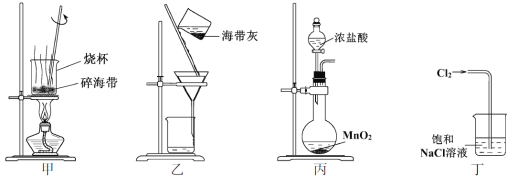
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
下列实验中的颜色变化,与氧化还原反应无关的是
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
Na2S溶液滴入AgCl浊液中
热铜丝插入稀硝酸中
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
沉淀由白色逐渐变为黑色
产生无色气体,随后变为红棕色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
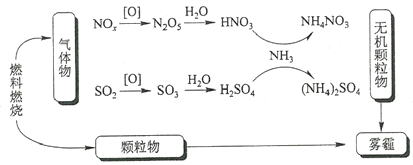
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
由下列实验及现象推出的相应结论正确的是
实验
现象
结论
A.某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有Fe2+,无Fe3+
B.向C6H5ONa溶液中通入CO2
溶液变浑浊
酸性:H2CO3>C6H5OH
C.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液
生成黑色沉淀
Ksp(CuS)<Ksp(ZnS)
D.①某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验操作不当的是
A. 用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B. 用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
C. 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+
D. 常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,124gP4中所含P—P键数目为4NA
B. 100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
难度: 中等查看答案及解析
-
下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4
CaCO3+SO42−
B. 酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+=I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO42−+3Cl−+4H++H2O
D. 电解饱和食盐水:2Cl−+2H+
Cl2↑+ H2↑
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaHCO3(s)
Na2CO3(s)
NaOH(aq)
B. Al(s)
NaAlO2(aq)
Al(OH)3(s)
C. AgNO3(aq)
[Ag(NH3)2]+(aq)
Ag(s)
D. Fe2O3(s)
Fe(s)
FeCl3(aq)
难度: 中等查看答案及解析
-
在(NH4)2Fe(SO4)2溶液中逐滴加入100 mL 1mol/L的Ba(OH)2溶液,把所得沉淀过滤、洗涤、干燥,得到的固体质量不可能是( )
A. 35. 3g B. 33.5g C. 32.3g D. 11.3g
难度: 中等查看答案及解析
-
在氧气中灼烧0.44 g S和Fe组成的化合物,使其中的S全部转化成H2SO4,这些H2SO4可用20 mL 0.5 mol/L的NaOH溶液完全中和,则原化合物中S的质量分数约为( )
A. 18% B. 46% C. 53% D. 36%
难度: 中等查看答案及解析
-
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+C12→CO2+N2+C1-+H2O(未配平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是
A. 2 mol B. 3 mol C. 4 mol D. 6 mol
难度: 中等查看答案及解析