-
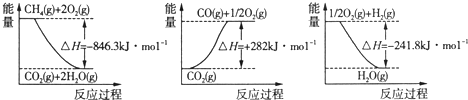
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
A. 检测时,电解质溶液中的H+向负极移动
B. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C. 电池反应的化学方程式为:CH3CH2OH + O2= CH3COOH + H2O
D. 正极上发生的反应为:O2+ 4e-+ 2H2O = 4OH-
难度: 中等查看答案及解析
-
化学与材料、生活和环境密切相关。下列有关说法中错误的是
A. 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
B. 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用
C. 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应
D. 神舟10 号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L SO3所含的氧原子数为1.5NA
B. 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
C. 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA
D. 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
难度: 简单查看答案及解析
-
下列有关溶液组成的描述合理的是
A.在Fe2(SO4)3溶液中可以大量存在: K+、Fe2+、Cl-、Br-、SCN-
B.c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、HCO3-、NO3-
C.加水稀释时c(OH-)/c (H+)值增大的溶液中可大量存在:MnO4-、CO32-、K+、NH4+
D.在碱性溶液中可以大量存在:S2O32- 、AlO2-、SiO32-、S2- 、Na+
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物。常温下,Z的单质能溶于X的最高价氧化物水化物的稀溶液,不溶于其浓溶液。下列说法正确的是
A. 元素Y的最高正化合价为+6 B. 简单离子半径的大小顺序:X>Y>Z
C. 简单气态氢化物的稳定性:X>Y D. 元素X和Y能形成离子化合物
难度: 中等查看答案及解析
-
将少量SO2气体通入BaCl2和FeCl3的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
A. 该实验表明SO2有漂白性 B. 白色沉淀为BaSO3
C. 该实验表明FeCl3有还原性 D. 反应后溶液酸性增强
难度: 中等查看答案及解析
-
已知0.1mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
A. 在Na2A、NaHA两溶液中,离子种类不相同
B. 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C. 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D. 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)> c(OH-)
难度: 中等查看答案及解析
-
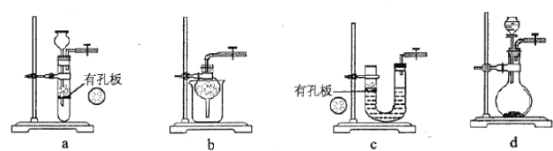
下列装置或操作能达到实验目的的是
A. 验证反应的热效应
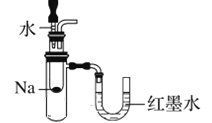 B. 定量的测定化学反应速率
B. 定量的测定化学反应速率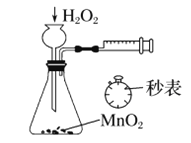 C. 滴定法测硫酸亚铁的溶度
C. 滴定法测硫酸亚铁的溶度 D. 构成铜锌原电池
D. 构成铜锌原电池
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
选项
实验操作
实验目的或结论
A
向某溶液中加入稀盐酸,放出无色剌激性气味气体,将气体通入澄清石灰水变混浊
证明该溶液中存在SO32-
B
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝
证明溶液中有NH4+
C
将Cl2通入品红溶液中,品红溶液褪色
证明Cl2的还原性
D
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
证明氧化性:H2O2比Fe3+强
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
FeCO3与砂糖混用可以作补血剂,实验室中制备FeCO3的流程如下图所示。下列说法错误的是
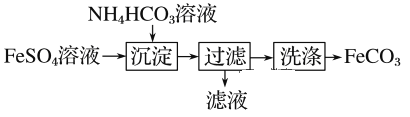
A. 可利用KSCN溶液检验FeSO4溶液是否变质
B. 沉淀过程中有CO2气体放出
C. 过滤操作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D. 产品FeCO3在空气中高温分解可得到纯净的FeO
难度: 中等查看答案及解析
-
甲、乙两个电解池均以Pt为电极且互相串联。甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液,通电一段时间后,测得甲池阴极质量增加2.16g,乙池电极析出0.24g金属,则乙池中溶质可能是
A. CuSO4 B. MgSO4 C. Al(NO3)3 D. Na2SO4
难度: 困难查看答案及解析
-
下列说法正确的是
A. 甲烷和Cl2的反应类型与乙烯和Br2的反应类型相同
B. 分子式为C4H7ClO2,可与NaHCO3反应产生CO2的有机物可能有3种结构
C.
分子中至少有11个碳原子处于同一平面上
D. 1mol有机物
 一定条件下能和7molNaOH反应
一定条件下能和7molNaOH反应难度: 中等查看答案及解析
-
(题文)某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
A. 9种 B. 6种 C. 5种 D. 4种
难度: 困难查看答案及解析
-
1.52 g 铜镁合金完全溶解于50 mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况}。向反应后的溶液中加入1.0mol/LNaOH 溶液,当金属离子全部沉淀时,得到2.54 g 沉淀。下列说法不正确的是
A. 该合金中铜与铁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. 得到2.54 g 沉淀时,加入NaOH 溶液的体积是600 mL
D. NO2和N2O4的混合气体中,NO2 的体积分数是80%
难度: 简单查看答案及解析