-
化学与生活密切相关。下列说法错误的是( )
A. 碳酸氢钠可用于治疗胃酸过多
B. 漂白粉可用于生活用水消毒
C. 碳纳米管属于有机高分子材料,可用于储存氢气
D. 过氧化钠可用于呼吸面具供氧
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 20g重水与18g水中,中子数比为2:1
B. 常温常压下,0.5 molO3与11.2 LO2 所含的分子数均为0.5NA
C. 6.0 g SiO2 中含有0.1NA个SiO2分子
D. 1mol过氧化钠和1mol氧化钠中阴阳离子个数比相同
难度: 中等查看答案及解析
-
甲苯是重要的化工原料,下列有关甲苯的说法错误的是( )
A. 甲苯可以与液溴混合后加入铁粉生成
B. 甲苯可以被高锰酸钾溶液氧化
C. 甲苯所有碳原子在同一个平面
D. 甲苯可与浓硝酸在浓硫酸催化下发生取代反应
难度: 中等查看答案及解析
-
下列实验过程可以达到实验目的的是( )
编号
实验目的
实验过程
A
探究浓度对反应速率的影响
向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象
B
探究氯化银和碘化银的Ksp大小
向2支盛有5 mL浓度均为0.1mol/L的AgNO3溶液的试管中同时分别滴加等浓度的NaI 溶液和NaCl 溶液,观察实验现象
C
制备纯净的二氧化碳气体
向盛有碳酸钙固体的锥形瓶中加入6mol/L盐酸,将生产的气体依次通过饱和Na2CO3溶液、浓硫酸
D
中和反应反应热测定
分别用量筒取50mL0.5mol/L的盐酸和氢氧化钠溶液,记录初始温度,然后将其分别倒入反应中和热测定容器,记录混合后溶液最高温度
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
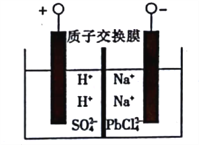
某种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水(酸性)中的有机物可用C6H10O5表示[交换膜分别是只允许阴(阳)离子通过的阴(阳)离子交换膜],下列有关说法中不正确的是( )
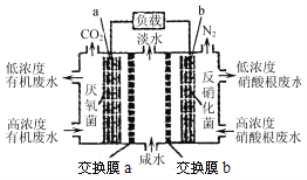
A. 电池工作时,电子由a极经导线流向b极
B. 交换膜a是阴离子交换膜
C. 电极b的反应式:2NO3-+10e-+12H+=N2↑+6H2O
D. 相同时间内(相同状况下)生成CO2和N2的体积比为2:5
难度: 困难查看答案及解析
-
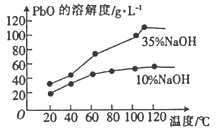
常温下,0.1 mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数(分布系数)随pH变化的关系如右图所示。下列表述不正确的是
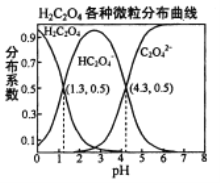
A. HC2O4-
H++C2O42-,K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. 常温下HF的K=1×10-3.4,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D. 在0.1 mol/L NaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
难度: 困难查看答案及解析
-
如图是部分短周期元素的单质及其化合物(或溶液)的转化关系,已知单质B2、C2、D2、E2在常温常压下都是气体,化合物G的焰色反应为黄色;化合物I、J、K通常状况下呈气态。下列说法正确的是( )
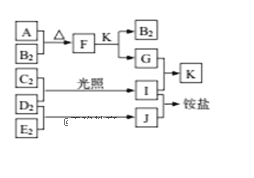
A. B氢化物的沸点高于其同主族其它元素氢化物的沸点
B. 原子半径大小:A>C>B>E>D
C. F中既含有离子键又含有极性共价键
D. G中的阴离子能抑制水的电离
难度: 困难查看答案及解析




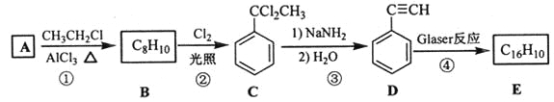
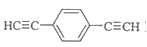 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。