-
短周期元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A. 同周期元素中X的金属性最强 B. 原子半径X>Y,离子半径X+>Z2-
C. 同族元素中Z的氢化物稳定性最高 D. 同周期元素中Y的最高价含氧酸酸性最强
难度: 简单查看答案及解析
-
下列除去杂质的方法不正确的是( )
A. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B. 用过量氨水除去Fe3+溶液中的少量Al3+
C. 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D. Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 过氧化钠与水反应:2O22-+2H2O=O2↑+4OH-
B. NaOH溶液与氯化铵溶液共热:OH-+NH4+
NH3↑+H2O
C. 氯气与水反应:Cl2+H2O
Cl-+ClO-+2H+
D. 氯化铁溶液刻蚀铜电路板:Fe3++Cu=Cu2++Fe2+
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Al3+、Cl-、SO42—
B. 在无色透明的溶液中:K+、Cu2+、NO3—、SO42—
C. 含有0.1 mol·L−1 Ca2+的溶液中:Na+、K+、CO32—、Cl-
D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3—、SO42—
难度: 简单查看答案及解析
-
下列实验操作中错误的是( )
A. 萃取操作时,应选择密度比水大的萃取剂
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 蒸发操作时,不能等到混合物中的水分完全蒸干后,才停止加热
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,2.24LSO3分子数为0.1NA
C. 加热条件下,1 mol Fe投入足量的浓硫酸中,生成NA个SO2分子
D. 0.1molNa2O2与足量潮湿的二氧化碳反应转移的电子数为0.1NA
难度: 简单查看答案及解析
-
在aL硫酸铝和硫酸铵的混合溶液中加入bmol氯化钡,恰好使溶液中的SO42-完全沉淀;若加入足量强碱并加热可得到cmol氨气,则原溶液中Al3+的浓度(mol/L)为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
关于如下反应:HgS+O2
Hg+SO2,下列叙述不正确的是
A.该反应是置换反应 B.该反应转移了4e-
C.Hg是被还原得到的产物 D.HgS既是还原剂又是氧化剂
难度: 简单查看答案及解析
-
向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 有铜无铁 B. 有铁无铜 C. 铁、铜都有 D. 铁、铜都无
难度: 中等查看答案及解析
-
化学无处不在,与化学有关的说法不正确的是 ( )
A. 侯氏制碱法的工艺过程中应用了物质溶解度的差异
B. 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
C. 碘是人体必需微量元素,所以要多吃富含高碘酸的食物
D. 黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成
难度: 简单查看答案及解析
-
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
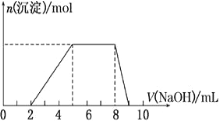
A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
难度: 困难查看答案及解析
-
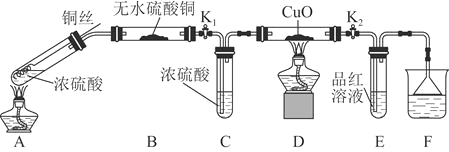
利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是
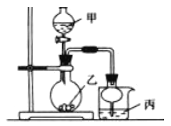
实验
试剂甲
试剂乙
试剂丙
丙中的现象
A
浓硫酸
亚硫酸钠
紫色石蕊试液
溶液先变红后褪色
B
浓盐酸
高锰酸钾
淀粉碘化钾溶液
溶液会变蓝
C
稀盐酸
碳酸钙
氯化钡溶液
有白色沉淀生成
D
浓氨水
氧化钙
氯化铝溶液
先生成白色沉淀然后沉淀溶解
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
将22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.2molNO2和0.3molNO,下列说法正确的是
A. 反应后生成的盐只有硝酸铁
B. 反应后生成的盐只有硝酸亚铁
C. 反应后生成的盐为硝酸亚铁和硝酸铁,其物质的量之比为1:3
D. 反应后生成的盐为硝酸亚铁和硝酸铁其物质的量之比为3:1
难度: 简单查看答案及解析
-
LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:①2LiAlH4
2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列说法正确的是
A. 若反应①中生成3.36L氢气,则一定有2.7g铝生成
B. 氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑
C. 生成等质量的氢气,反应①②转移电子数之比为4:3
D. LiAlH4是共价化合物,LiH是离子化合物
难度: 中等查看答案及解析
-
已知
位于同一周期,下列关系正确的是
A. 还原性:As3->S2->Cl-
B. 热稳定性:HCl>AsH3>HBr
C. 原子半径:As>Cl>P
D. 酸性:H3AsO4>H2SO4>H3PO4
难度: 简单查看答案及解析
-
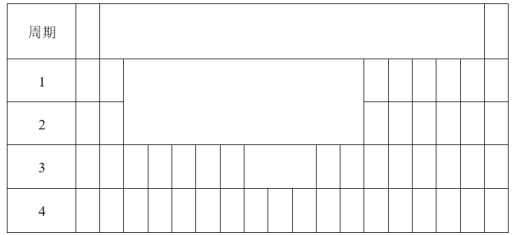
如图为元素周期表的一部分,下列有关短周期元素X、Y、Z、R的叙述正确的是

A. 热稳定性:Y的最简单气态氢化物大于Z的最简单气态氢化物
B. Z的最高价氧化物对应水化物的分子式为H2ZO4
C. X元素的单质能与所有强酸发生反应放出H2
D. R的核外电子数与OH-的核外电子总数相同
难度: 简单查看答案及解析
-
短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如图所示,其中戊是同周期中原子半径最小的元素。下列有关判断正确的是
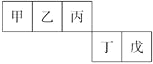
A. 最外层电子数:甲
乙
丙
丁
戊
B. 简单离子的离子半径:戊
丁
C. 含有丁元素的酸有多种
D. 乙的氢化物多种多样,丙、丁、戊的氢化物各有一种
难度: 中等查看答案及解析
-
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大,下列说法正确的是
A. M与X形成的化合物对应的水化物一定是强酸
B. Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同
C. X、Y的简单离子半径:X>Y
D. M的气态氢化物比X的气态氢化物稳定
难度: 简单查看答案及解析
-
已知1~18号元素的离子
都具有相同的电子层结构,则下列叙述或表示方法正确的是
A. 四种元素位于同一周期
B. 氢化物的稳定性H2Y>HZ
C. 离子的氧化性
D. a+3<c-2
难度: 简单查看答案及解析
-
有一无色透明溶液,取出少量滴入氯化钡溶液,只有白色沉淀生成;另取一定体积的无色溶液加入过量过氧化钠,有无色无味气体产生,同时有白色沉淀生成,其沉淀量与加入过氧化钠的量关系如图所示,则①H+②NH4+③Al3+④Mg2+⑤Fe2+⑥NO3-⑦SO42-⑧CO32-中一定存在的离子是

A. ③④⑧ B. ③④⑦ C. ②③④⑧ D. ①③④⑦
难度: 中等查看答案及解析