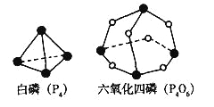
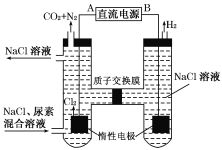
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
A. 检测时,电解质溶液中的H+向负极移动
B. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C. 电池反应的化学方程式为:CH3CH2OH + O2= CH3COOH + H2O
D. 正极上发生的反应为:O2+ 4e-+ 2H2O = 4OH-
难度: 中等查看答案及解析
-
下列反应中生成物的总能量高于反应物的总能量的是
A. Zn与稀硫酸反应放出氢气 B. 醋酸和氢氧化钠的中和反应
C. 硫在空气中燃烧 D. Ba(OH)2·8H2O与NH4Cl反应
难度: 简单查看答案及解析
-
下列热化学方程式中△H代表燃烧热的是( )
A. CH4(g)+3/2O2(g)=2H2O(l)+CO(g) △H1
B. S(s)+3/2O2(g)=SO3(s) △H2
C. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) △H3
D. 2CO(g)+O2(g)=2CO2(g) △H4
难度: 中等查看答案及解析
-
已知:S(g) + O2 (g) = SO2(g) ΔH=-Q1kJ/mol ; S(s) + O2 (g) = SO2(g) ΔH=-Q2 kJ/mol。 则Q1 Q2
A. 大于 B. 小于 C. 等于 D. 无法比较
难度: 简单查看答案及解析
-
X、Y、Z、M、N五种金属,有以下化学反应:
(1)水溶液中X+Y2+=X2++Y;
(2)Z+2H2O(冷水)=Z(OH)2+H2↑;
(3)M、N为电极,与N盐溶液组成原电池,M电极反应为M-2e-=M2+;
(4)Y可以溶于稀硫酸中,M不被稀硫酸氧化。
则这五种金属的活动性由弱到强的顺序是
A. M<N<Y<X<Z B. N<M<X<Y<Z
C. N<M<Y<X<Z D. X<Z<N<M<Y
难度: 中等查看答案及解析
-
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸溶液,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是
A. Pb为正极被氧化 B. 溶液的PH值不断减小 C. SO42-浓度不变 D. 两电极质量均增加
难度: 中等查看答案及解析
-
用惰性电极电解下列溶液,一段时间后,加入一定质量的另一种物质(中括号内),溶液能恢复到电解前的情况的是
A. CuCl2[CuSO4] B. NaOH[Na2O] C. NaCl[HCl] D. CuSO4[Cu(OH)2]
难度: 中等查看答案及解析
-
下列有关钢铁腐蚀与防护的说法正确的是
A. 钢管与电源正极连接,钢管可被保护
B. 铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C. 钢管与铜管露天堆放在一起,钢管不易被腐蚀
D. 钢铁发生析氢腐蚀时,负极反应是
难度: 中等查看答案及解析
-
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O
HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B. 合成氨工业中使用铁触媒做催化剂
C. 合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
D. 对2HI(g)
H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
难度: 中等查看答案及解析
-
已知反应FeO(s)+C(s)=CO(g)+ Fe(s) 的△H>0,△S >0(假定△H、△S不随温度而变化),下列叙述中正确的是( )
A. 低温下为自发过程,高温下为非自发过程 B. 高温下为自发过程,低温下为非自发过程
C. 任何温度下均为非自发过程 D. 任何温度下均为自发过程
难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(g)
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的65%,则
A. 平衡向逆反应方向移动了 B. 物质B的质量分数增加了
C. 物质A的转化率减小了 D. a>b
难度: 中等查看答案及解析
-
密闭容器中反应:A2+B2
2AB,产物AB的生成情况如图所示,a为500℃,b为300℃ 时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是
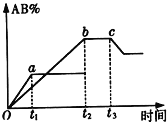
A. A2、B2、AB均为气体,正反应放热
B. AB为气体,A2、B2中最少有一种为非气体,正反应吸热
C. AB为气体,A2、B2中最少有一种为非气体,正反应放热
D. AB为固体,A2、B2中最少有一种为非气体,正反应吸热
难度: 中等查看答案及解析
-
下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是
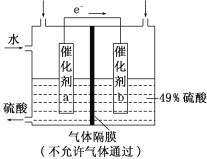
A. 该装置将化学能转化为电能
B. 催化剂b表面O2发生还原反应,其附近酸性增强
C. 催化剂a表面的反应是:SO2+2H2O-2e-===SO42-+4H+
D. 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15
难度: 困难查看答案及解析
-
一定条件下,在恒容密闭容器中,能表示反应X+2Y
2Z一定达到化学平衡状态的是
A. Z(气体)的浓度不再发生变化 B. X、Y、Z的物质的量之比是1∶2∶2
C. 容器气体的总压强不再发生变化 D. 单位时间内生成n mol Z,同时消耗2n mol Y
难度: 简单查看答案及解析
-
一定条件下存在反应C(s)+H2O(g)
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器
甲
乙
丙
容积
0.5 L
0.5 L
V
温度
T1℃
T2℃
T1℃
起始量
2 molC
1 molH2O
1 molCO
1 molH2
4 molC
2 molH2O
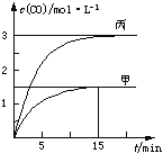
A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
难度: 中等查看答案及解析
-
反应N2O4(g)⇌2NO2(g)△H=+57kJ•mol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是

A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、B两点气体的平均相对分子质量:A>B
D. B、C两点化学平衡常数:B<C
难度: 中等查看答案及解析