-
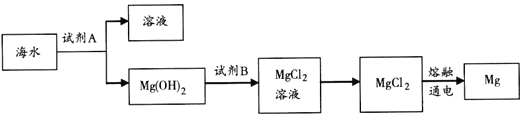
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A. 原子半径:r(X) < r(Y) < r(Z) < r(W)
B. W的最高价氧化物的水化物是一种弱碱
C. Y的单质的氧化性比Z的强
D. X、Y、Z 三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 1mol/L的NaCl溶液中含有的离子总数为2NA
B. 1 mol Na2O2与CO2完全反应时转移电子数为2NA
C. 标准状况下,22.4LH2O含有的 H—O键数为2NA
D. 18g 18O2中含有的中子数为10NA
难度: 中等查看答案及解析
-
我清代《本草纲目拾遗》中记载药物“鼻冲水”写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅……虚弱者忌之。宜外用,勿服”。“鼻冲水”的主要成分可能是
A. 醋 B. 氢氟酸
C. 氨水 D. 稀硫酸
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则1 mol硫酸与足量氢氧化钡溶液反应放热为114.6 kJ
B. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(1)=2H2(g)+O2(g)反应的△H=+571.6kJ·mol-1
C. 反应物的热效应与是否使用催化剂有关
D. 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g) + 3H2(g) ⇌ 2NH3(g) △H= -38.6 kJ·mol-1
难度: 中等查看答案及解析
-
下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有FeCl3+3KSCN⇌3KCl+Fe(SCN)3(血红色)反应,平衡后向体系中加入KCl固体使体系红色变浅。
C. 装有NO2的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
在一恒温恒容容器中,发生反应:2A(g)+B(s) ⇌ C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内B(s)物质的量浓度不变;②混合气体的密度不变;③混合气体的压强不变;④混合气体的平均相对分子质量不变;⑤C(g)的物质的量浓度不变;⑥容器内A、C、D三种气体的浓度之比为2:1:1;⑦某时刻v(A)=2v(C)且不等于零;⑧单位时间内生成n mol D,同时生成2n mol A
A. 3 B. 4 C. 5 D. 6
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式不正确的是( )
A. 向Al2(SO4)3溶液中加入过量氨水:Al3++ 3NH3·H2O=Al(OH)3↓+ 3NH4+
B. Cl2与H2O反应:Cl2+H2O=2H++ClO-+Cl-
C. 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O
D. 碳酸氢钙溶液中加入足量烧碱溶液:Ca2+ +2HCO3-+2OH-=CaCO3 ↓+CO32- +2H2O
难度: 简单查看答案及解析
-
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷(C2H6)和氧气,其中某一电极反应式为C2H6+18OH−−14e−===2CO32−+12H2O。有关此电池的推断不正确的是
A. 通入乙烷的电极为负极
B. 放电一段时间后,KOH的物质的量浓度将下降
C. 参加反应的O2与C2H6的物质的量之比为2∶7
D. 溶液中的OH−向负极移动
难度: 简单查看答案及解析
-
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同主族,B和D同主族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的气态化合物在水中呈碱性,C和E形成化合物为CE。下列说法不正确的是( )
A. 稳定性BA3>DA3>AE
B. B离子的半径大于C离子的半径
C. 将C的单质放入CuSO4溶液中会有蓝色沉淀产生
D. E的最高价氧化物对应水化物的化学式为HEO4
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u能使品红溶液退色,v的俗名叫烧碱。上述物质的转化关系如图所示。下列说法正确的是( )
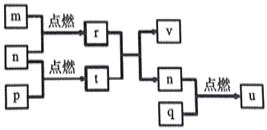
A. 原子半径的大小:W>Z>Y>X
B. t与r反应时,r为氧化剂
C. 生活中可用u使食物增白
D. Z分别与Y、W组成的化合物中化学健类型可能相同
难度: 中等查看答案及解析
-
一定温度下,在恒容密闭容器中发生反应2HI(g)+Cl2(g)
2HCl(g) + I2(s)。下列事实不能说明该反应到平衡状态的是( )
A. 断裂1 mol Cl-Cl键同时形成1 mol H-Cl键 B. 容器内气体密度不再改变
C. 容器内气体压强不再改变 D. 容器内气体颜色不再改变
难度: 简单查看答案及解析
-
为测定一小块铁铝合金样品中的含铝量,现先将其溶于足量盐酸中,然后再向其中加入足量的烧碱溶液,待沉淀全部转化为红褐色时过滤、洗涤,将沉淀物在空气中灼烧,最后得到红棕色粉末,经称量知其质量跟原合金的质量相等。合金中铝的质量分数为
A. 无法计算 B. 70% C. 54% D. 30%
难度: 中等查看答案及解析
-
下图是2SO3(g)
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )

A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g)
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
难度: 简单查看答案及解析
-
为了探究外界条件对反应aX(g)+bY(g)⇌cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是( )
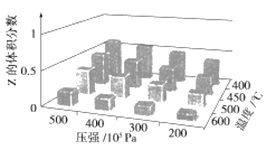
A. ΔH>0,ΔS>0
B. ΔH>0,ΔS<0
C. ΔH<0,ΔS>0
D. ΔH<0,ΔS<0
难度: 困难查看答案及解析
-
反应N2O4(g)
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
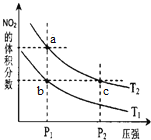
A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
难度: 困难查看答案及解析
-
某恒定温度下,在一个2L的密闭容器中充入A气体、B气体,其浓度分别为2 mol/L,1 mol/L,且发生如下反应:3A(g)+2B(g) ⇋4C(?)+2D(?)已知“?”代表C、D状态未确定;反应一段时间后达到平衡,测得生成1.6 mol C,且反应前后压强比为5:4,则下列说法中正确的是( )
①该反应的化学平衡常数表达式为:

②此时B的转化率为35%
③增大该体系压强,平衡向右移动,但化学平衡常数不变
④增加C的量,A、B转化率不变
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
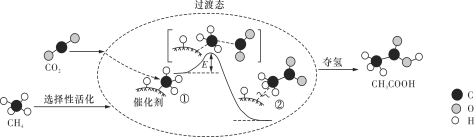
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C—H键发生断裂
C. ①→②放出能量并形成了C—C键
D. 该催化剂可有效提高反应物的平衡转化率
难度: 中等查看答案及解析
-
在一定温度下,向一个体积不变的密闭容器中,充入等物质的量的氮气和氢气,发生反应:N2+3H2
2NH3,下列不能说明反应一定达到平衡状态的是
A. 密度保持不变 B. 氢气的物质的量分数保持不变
C. 容器的压强保持不变 D. 气体的平均相对分子质量不变
难度: 中等查看答案及解析