-
下列离子方程式错误的是
A. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42-=BaS04↓+2H2O
B. 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+ 8H2O
C. 等物质的量的MgCl2、Ba(OH)2和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
D. 铅酸蓄电池充电时的正极反应:PbSO4+ 2H2O-2e- = PbO2+4H++SO42-
难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的10 mol/L硫酸混合微热,产生下列现象:①有红色金属生成
②产生刺激性气味的气体 ③溶液呈现蓝色。请你据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. NH4CuSO3中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1 mol NH4CuSO3完全反应转移0.5 mol电子
难度: 中等查看答案及解析
-
下列有关金属及其合金的说法不正确的是
A. 目前我国流通的硬币是由合金材料制造的
B. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
C. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D. 生铁、普通钢和不锈钢中的碳含量依次增加
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,1mol P4中所含P-P键数目为4NA
B. 100mL 1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为4NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
难度: 困难查看答案及解析
-
宋应星所著《天工开物》被外国学者誉称为17世纪中国工艺百科全书。下列说法不正确的是
A. 凡白土曰垩土,为陶家精美启用中陶是一种传统硅酸盐材料
B. 每红铜六斤,入倭铅四斤,先后入罐熔化,冷定取出,即成黄铜中的黄铜是合金
C. 烧铁器淬于胆矾水中,即成铜色也,该过程中反应的类型为复分解反应
D. 凡火药,硫为纯阳,硝为纯阴中硫指的是硫黄.硝指的是硝酸钾
难度: 中等查看答案及解析
-
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中,加入150mL 4 mol·L−1的稀硝酸,恰好使混合物完全溶解,并放出标准状况下NO气体2.24L,往所得溶液中加KSCN溶液,无红色出现。若用一定量的氢气在加热条件下还原相同质量的该混合物,所得固体的物质的量可能为
A. 0.30mol B. 0.28mol C. 0.25mol D. 0.42mol
难度: 困难查看答案及解析
-
(题文)4℃时,在100 mL水中溶解22.4L HCl气体(标准状况下)形成溶液。下列说法正确的是
A. 该溶液的物质的量浓度为10 mol·L−1
B. 由于溶液的密度未知,故该溶液的物质的量浓度无法求得
C. 由于溶液的密度未知,故该溶液中溶质的质量分数无法求得
D. 所得溶液的体积为22.5L
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红的溶液中:Na、Cl—、CH3COO—、Fe2+
B. 水电离的OH—浓度为10−12 mol·L−1的溶液中:Mg2+、NH4+、AlO2—、SO32—
C. 无色溶液中:Al3+、NO3—、Cl—、SO42—
D. c(H2C2O4)=0.5mol·L−1溶液中:Na、K+、MnO4—、Cl—
难度: 中等查看答案及解析
-
如果用0.3 mol·L−1的亚硫酸钠溶液16mL,恰好将3.2×10−3mol的强氧化剂[RO(OH)2]2+溶液的溶质还原到较低价态。则反应后R的最终价态为
A. 0 B. +1 C. +2 D. +3
难度: 困难查看答案及解析
-
120 mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A. 2.0 mol·L−1 B. 0.24 mol·L−1 C. 1.5 mol·L−1 D. 0.18 mol·L−1
难度: 困难查看答案及解析
-
以下各项叙述中错误的是( )
A. 原子半径由小到大的顺序是Li<Na<K<Rb<Cs
B. 同一种碱金属元素的离子半径比原子半径小
C. 碱金属单质的密度比较为Li<K<Na<Rb
D. 碱金属离子的氧化性比较为Li+<Na+<K+<Rb+
难度: 中等查看答案及解析
-
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
①加盐酸溶解 ②加足量烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A. ①⑥⑤③ B. ②③④③ C. ②③⑤③ D. ①③⑤③
难度: 中等查看答案及解析
-
足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最多的是
A. 氢氧化钠溶液 B. 稀硫酸 C. 盐酸 D. 稀硝酸
难度: 中等查看答案及解析
-
已知X、Y、Z三种主族元素在元素周期表中的位置如图所示,设X的原子序数为a。则下列说法不正确的是
Y
X
Z
A. Y与Z的原子序数之和可能为2a B. Y的原子序数可能为a-17
C. Z的原子序数可能为a+31 D. X、Y、Z一定为短周期元素
难度: 中等查看答案及解析
-
Cu、Cu2O和CuO组成的混合物加入100mL 0.6mol·L−1 HNO3溶液,恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。下列说法不正确的是
A. 产物中硝酸铜的物质的量为0.025mol
B. 若混合物中Cu的物质的量为0.005mol,则其中Cu2O、CuO的物质的量共0.020mol
C. 若混合物中含0.01mol Cu,则其中Cu2O、CuO的物质的量均为0.005mol
D. 混合物中Cu的物质的量的取值范围为0.005mol<n(Cu)<0.015mol
难度: 中等查看答案及解析
-
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2−、MnO4−、CO32−、SO42−中的若干种组成,取该溶液进行如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据对上述实验的分析判断,最后得出的结论合理的是( )
A. 不能判断溶液中是否存在SO42− B. 溶液中一定不存在的离子是CO32−
C. 不能判断溶液中是否存在Ag+ D. 不能判断是否含有 AlO2− 离子
难度: 困难查看答案及解析
-
将盐酸溶液逐滴滴入NaOH、NaAlO2、Na2CO3的混合溶液中,下列图像能正确表示溶液中反应的是( )
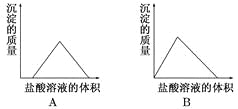
难度: 中等查看答案及解析
-
如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )

A. 稀硝酸对FeCr合金的腐蚀性比稀硫酸和稀盐酸的弱
B. 稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)===Fe(NO3)3+3NO2↑+3H2O
C. Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对FeCr合金的腐蚀性最强
D. 随着Cr含量增加,稀硝酸对FeCr合金的腐蚀性减弱
难度: 中等查看答案及解析
-
某同学设计下列方案对A盐的水解液进行鉴定:
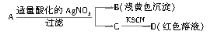 由此得出的结论中,不正确的是
由此得出的结论中,不正确的是A. D溶液中存在Fe(SCN)3 B. A一定为无氧酸盐FeBr2 C. B为AgBr D. 滤液中有Fe3+
难度: 中等查看答案及解析
-
下列反应过程中,同时有离子键、极性共价键和非极性共价键断裂和形成的反应是
A. NH4Cl
NH3↑+HCl↑ B. 2Na2O2+2CO2===2Na2CO3+O2
C. 2NaOH+Cl2===NaCl+NaClO+H2O D. CaC2+H2O===Ca(OH)2+C2H2
难度: 中等查看答案及解析
-
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为a g,则该混合物
A. 所含共用电子对数目为(a/7+1)NA B. 所含碳氢键数目为a NA/7
C. 燃烧时消耗的O2一定是33.6a/14L D. 所含原子总数为a NA/14
难度: 中等查看答案及解析
-
下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是
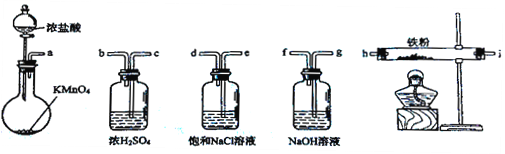
A. a-b-c-d-e-e-f-g-h B. a-e-d-c-b-h-i-g
C. a-d-e-c-b-h-i-g D. a-c-b-d-e-h-i-f
难度: 中等查看答案及解析
-
下列有关实验原理或操作正确的是
A. 用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%酒精溶液
B. 在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5mol·L−1
C. 实验中需用2.0 mol·L−1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL、201.4g
D. 实验室配制500 mL 0.2 mol·L−1的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶,洗涤、稀释、定容、摇匀
难度: 中等查看答案及解析
-
某混合溶液中,可能大量含有的离子如下表:
阳离子
H+、K+、Al3+、NH
、Mg2+
阴离子
OH-、SO42—、CO32—、AlO2—
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。
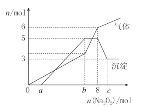
下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
难度: 困难查看答案及解析

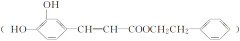 是一种天然抗癌药物。在一定条件下能发生如下转化。
是一种天然抗癌药物。在一定条件下能发生如下转化。