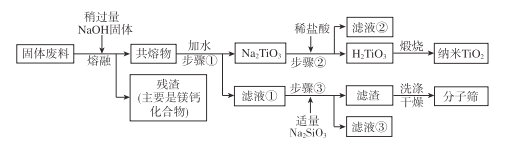
-
我国汉书中记载:“高奴县有洧水,可燃”,沈括在《梦溪笔谈》对洧水的使用有如下描述:“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也”,对上述史实记载分析正确的是( )
A. 该物质属于纯净物 B. 该物质可能属于无机化合物
C. 该物质是由同一类烃组成的混合物 D. 烟是该物质不完全燃烧的产物
难度: 简单查看答案及解析
-
在含有下列各离子组的溶液中,能大量共存且溶液为无色透明的是( )
A. Na+、Cu2+、Cl-、SO42― B. Ba2+、K+、OH-、NO3―
C. K+、Ca2+ 、NH4+、CO32― D. H+、Ca2+、Cl-、HCO3―
难度: 中等查看答案及解析
-
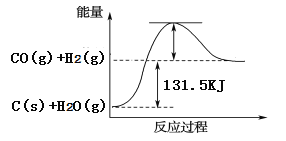
根据下图所给信息,得出的结论正确的是( )
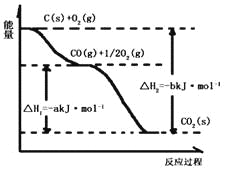
A. 碳的燃烧热为b kJ/mol
B. 2C(s) + O2(g)=2CO(g) △H=-2(b-a) kJ/mol
C. 2CO2(s)=2CO(g)+O2(g) △H=+a kJ/mol
D. C(s) + O2(g)=CO2(g) △H<-b kJ/mol
难度: 中等查看答案及解析
-
下列关于铜锌原电池(如图所示)的说法正确的是
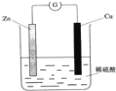
A. Zn是负极,发生还原反应 B. Cu是负极,发生氧化反应
C. 铜片上有气体逸出 D. 电子由铜片通过导线流向锌片
难度: 中等查看答案及解析
-
读下列药品标签,有关分析不正确的是
选项
A
B
C
D
物品标签




分析
该试剂应装在橡胶塞的细口瓶中
该药品不能与皮肤直接接触
该物质受热易分解
该药品物质的量浓度为18.4 mol·L-1
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列事实与胶体性质无关的是( )
A. 土壤中离子的吸附和交换过程,有保肥作用
B. 由肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
C. 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
D. 臭氧、Cl2均可用于水的消毒净化
难度: 中等查看答案及解析
-
下列有关氢原子(用H表示)与氢分子的说法中错误的是( )
A. 化学能:2molH >1molH2 B. H原子间发生碰撞就能转化为H2
C. 稳定性:H<H2 D. H2→2H的过程是吸热过程
难度: 中等查看答案及解析
-
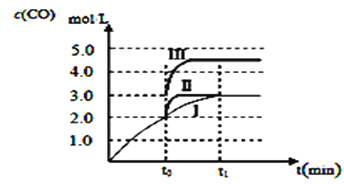
温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是
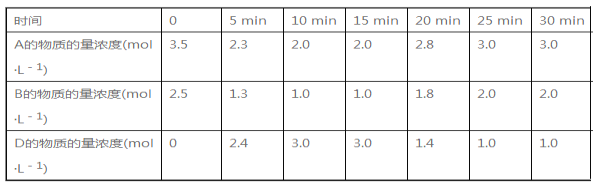
A. 前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B. 该反应的平衡常数表达式为K=c(C)c2(D)/[c(A)c(B)]
C. 若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D. 反应至15 min时,改变的条件可以是降低温度
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO−+ Cl−
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3−+2OH−===CaCO3↓+CO32−+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2−+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
难度: 中等查看答案及解析
-
CsICl2常用于化学上的分子筛技术,它既有氧化性又有还原性,下列有关的说法正确的是( )
A. CsICl2有氧化性,是因为Cs显+3价
B. CsICl2有还原性,是因为含有较强还原性的I-
C. 酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色
D. 在CsICl2溶液中滴加HNO3,可生成Cl2
难度: 中等查看答案及解析
-
在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)
C(g)+D(g)己达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1 : 1
A. ①③④⑤ B. ①③④⑤⑧⑨ C. ①②③④⑤⑦ D. ①②③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
下列关于物质分类的说法正确的是( )
①SO2和NO2都能和碱液反应,属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤NaHCO3是发酵粉的主要成分之一,Na2CO3可治疗胃酸过多
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物
A. ①③⑤ B. ④⑤⑥ C. ②③④ D. ②④⑥
难度: 中等查看答案及解析
-
关于反应过程中的先后顺序,下列评价正确的是( )
A. 向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B. 向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C. 向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D. 向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
难度: 中等查看答案及解析
-
已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是
①生成物的体积分数一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增加 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率
A. ①②④⑤ B. ①②③⑤ C. ②③ D. ②⑤
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 1L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA
B. 标准状况下,11.2 LNO与11.2LO2混合后所含分子数为0.75NA
C. Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA
D. 室温下,将9g铝片投入0.5L 18.4mol•L-1的H2SO4中,转移的电子数为NA
难度: 中等查看答案及解析
-
温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s
0
50
150
250
350
n(PCl3)/ mol
0
0.16
0.19
0.20
0.20
A. 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡时,c(PCl5) > 0.4mol·L-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C. 反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
D. 相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
难度: 中等查看答案及解析
-
将a g二氧化锰粉末加入c L b mol·L-1的浓盐酸中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 可以收集到氯气
L B. 反应后溶液中的Cl-数目为
C. NA可表示为
D. 反应后溶液中的H+数目为bc-2d
难度: 中等查看答案及解析
-
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O
+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. O2和S2O
是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子数为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1﹕1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
难度: 困难查看答案及解析
-
利用CO和H2在催化剂的作用下合成甲醇,反应如下:CO(g)+2H2(g)⇌ CH3OH(g),在2L密闭容器中充入物质的量之比为1:2的CO和H2,在催化剂作用下充分反应,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示,下列说法正确的是( )
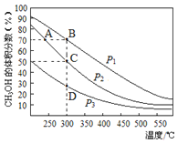
A. 该反应的△H<0,且p1<p2<p3
B. 在C点时,H2转化率为75%
C. 反应速率:ν逆(状态A)>ν逆(状态B)
D. 在恒温恒压条件下,向该密闭容器中再充入1molCH3OH,达平衡时CH3OH的体积分数增大
难度: 困难查看答案及解析
-
已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间的转化关系如图所示,下列说法错误的是
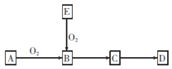
A. 若E、D的水溶液均呈酸性,则A为硫
B. 若D是一种难溶于水的物质,则A为硅
C. 若E、D的水溶液均呈酸性,则B能与水反应
D. 若D是一种难溶于水的物质,则B能与水反应
难度: 困难查看答案及解析
-
实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫元素等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
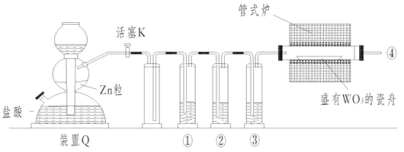
A. 管式炉加热前,用试管在④处收集气体后点燃,通过声音判断气体纯度
B. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
难度: 中等查看答案及解析
-
某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4
 LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MHM+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
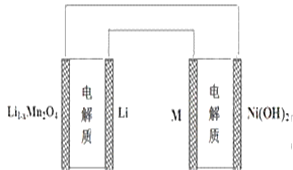
A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
难度: 中等查看答案及解析