-
下面关于中国化学史的表述错误的是( )
A. 《本草纲目》中记载“火药乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,其中的KNO3是利用了它的氧化性
B. 蔡伦利用树皮、碎麻布、麻头等原料精制出优质纸张
C. 杜康用高粱酿酒的原理,是通过蒸馏法将高梁中的乙醇分离出来
D. 英文的“中国”(China)又指“瓷器”,我国很早就依据化学原理制作陶瓷
难度: 简单查看答案及解析
-
下列对物质或离子的检验,结论正确的是 ( )
A. 加入KSCN溶液,溶液变红,证明原溶液含有Fe3+
B. 将气体通入KMnO4酸性溶液,紫色褪色,证明气体为SO2
C. 将气体通入澄清石灰水,有白色沉淀,证明气体为CO2
D. 加入BaCl2溶液,沉淀不溶于盐酸,证明原溶液含有SO42-
难度: 中等查看答案及解析
-
某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是
A. AlCl3 B. Na2O
C. FeCl2 D. SiO2
难度: 困难查看答案及解析
-
下列离子方程式的书写及评价均合理的是( )
选项
离子方程式
评价
A
将1molCl2通入到含1molFeI2溶液中:
2Fe2++2I﹣+2Cl2═2Fe3++4Cl﹣+I2
正确;
Cl2过量,可将Fe2+、I﹣均氧化
B
1mol•L﹣1的NaAlO2溶液和2.5mol•L﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+═Al3++Al(OH)3↓+H2O
正确;AlO2﹣与Al(OH)3消耗的H+的物质的量之比为2:3
C
过量SO2通入到NaClO溶液中:
SO2+H2O+ClO﹣═HClO+HSO3﹣
正确;
说明酸性:H2SO3强于HClO
D
Ca(HCO3)2溶液与足量的NaOH溶液反应:
Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O
正确;
酸式盐与碱反应生成正盐和水
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组离子,在溶液中能大量共存的是 ( )
A. S2-、Na+、SO32-、H+ B. Na+、HCO3-、Cl-、OH-
C. Na+、Al3+、Cl-、SO42- D. H+、Fe2+、NO3-、SO42-
难度: 中等查看答案及解析
-
下列不属于空气质量播报内容的是
A.SO2 B.CO2 C.NO2 D.PM2.5
难度: 简单查看答案及解析
-
下列做法会对人体健康造成较大危害的是( )
A. 用大量SO2漂白银耳
B. 用小苏打(NaHCO3)焙制糕点
C. 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3)
D. 用消毒液(有效成分NaClO)对餐具进行杀菌消毒
难度: 中等查看答案及解析
-
下列说法中,不正确的是
A.常温下可用铁制容器盛装浓硝酸 B.氧化铁常用作红色油漆和涂料
C.硅胶常用作食品、药品干燥剂 D.生石灰可用作食品的抗氧化剂
难度: 中等查看答案及解析
-
要证明CuSO4溶液显蓝色不是由于SO42-造成的,下列实验无意义的是
A. 观察K2SO4溶液的颜色
B. 加水稀释CuSO4溶液,溶液颜色变浅
C. 向CuSO4溶液中滴加过量NaOH溶液,振荡后静置,溶液变成无色
D. 向CuSO4溶液中滴加过量Ba(NO3)2溶液,振荡后静置,溶液未变成无色
难度: 中等查看答案及解析
-
将下列气体通入溶有足量 SO2 的 BaCl2 溶液中, 没有沉淀产生的是
A. HCl B. NH3 C. Cl2 D. NO2
难度: 中等查看答案及解析
-
某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生,为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是
选项
实验及现象
结论
A
将湿润的红色石蕊试纸放在试管口,试纸变蓝
反应中有NH3产生
B
收集产生的气体并点燃,火焰呈淡蓝色
反应中有H2产生
C
收集气体的同时测得溶液的pH为8.6
弱碱性溶液中Mg也可被氧化
D
将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生
弱碱性溶液中OH-氧化了Mg
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
二氧化硫能使溴水褪色,说明二氧化硫具有( )
A. 还原性 B. 氧化性 C. 漂白性 D. 酸性
难度: 简单查看答案及解析
-
中学化学中很多“规律”都有其使用范围,据有关“规律”下列结论合理的是
A. 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
B. 金属钠可以通过电解熔融NaCl制得,推出金属铝可以通过电解熔融AlCl3制得
C. 金属钠在纯氧中燃烧生成Na2O2,推出金属锂在纯氧中燃烧生成Li2O2
D. CaCO3与稀硝酸反应生成CO2,推出CaSO3也能与稀硝酸反应生成SO2
难度: 中等查看答案及解析
-
铜和Al的合金2.3g全溶于浓硝酸,若反应中硝酸被还原只产生2.24L的NO2气体和168mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入一定量的氢氧化钠溶液,使生成的沉淀的最大质量为
A. 4.1275g B. 4.255g C. 8.51g D. 9.62g
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数。下列叙述中正确的是( )
A. 标准状况下,22.4 L SO3中含SO3分子数为NA
B. 46 g NO2中含有分子数为NA
C. 标况下22.4L Cl2与足量的NaOH溶液反应,转移的电子数为2NA
D. 标况下,足量的Fe与22.4L Cl2发生燃烧反应(Cl2完全反应),转移的电子数为2NA
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A. Fe
Fe2O3
FeCl3(aq)
B. N2
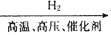 NH3
NH3 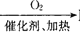 NO
NOC. SiO2
H2SiO3
Na2SiO3(aq)
D. Al2O3
Al(OH)3
AlCl3(aq)
难度: 中等查看答案及解析
-
解释下列事实的方程式不正确的是( )
A. Al溶于NaOH溶液:2Al + 2H2O + 2NaOH ==2NaAlO2 + 3H2↑
B. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH-=SiO32- + H2O
C. 热的浓NaOH溶液与NH4Cl液混合产生气体:NH4+ + OH-
NH3↑+ H2O
D. 实验室用NaOH溶液吸收多余的NO2:3NO2 +2OH—=2NO3—+H2O+NO↑
难度: 中等查看答案及解析
-
检验氯化氢气体中是否混有氯气,不可采用的方法是
A.用湿润的有色布条 B.用湿润的蓝色石蕊试纸
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
难度: 中等查看答案及解析
-
如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是( )
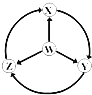 (选项中按 W X Y Z 的顺序)
(选项中按 W X Y Z 的顺序)A. S SO2 SO3 H2SO4 B. Na Na2O2 NaOH NaCl
C. Fe FeCl3 Fe(OH)2 FeCl2 D. Al AlCl3 NaAlO2 Al2(SO4)3
难度: 中等查看答案及解析
-
在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述不正确的是( )
A. 白色沉淀不含BaSO3 B. 溶液的酸性减弱 C. 白色沉淀是BaSO4 D. FeCl3全部被还原为FeCl2
难度: 中等查看答案及解析
-
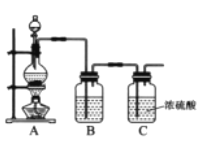
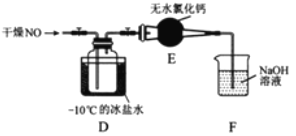
探究浓硫酸和铜的反应,下列装置或操作正确的是
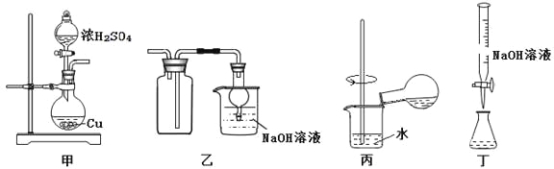
A. 用装置甲进行铜和浓硫酸的反应
B. 用装置乙收集二氧化硫并吸收尾气
C. 用装置丙稀释反应后的混合液
D. 用装置丁测定余酸的浓度
难度: 中等查看答案及解析
-
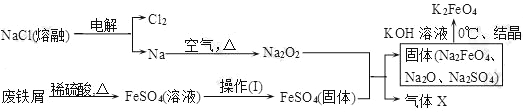
下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是
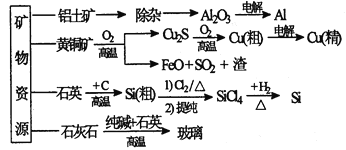
A. 粗铜电解精炼时,粗铜作阳极
B. 生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C. 黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
难度: 中等查看答案及解析
-
铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图甲所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图乙所示。则下列分析正确的是( )
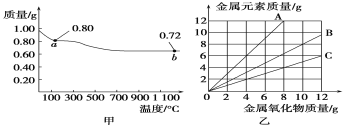
A. 图甲中a点和b点对应物质的化学式分别为Cu2O和CuO
B. 图甲整个过程中共生成0.26 g水
C. 图乙三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图甲中,a到b的过程中有0.01 mol电子发生了转移
难度: 中等查看答案及解析