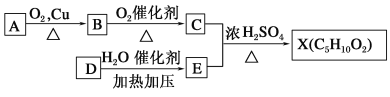
-
下列过程中,共价键被破坏的是( )
A. 碘升华 B. 溴蒸气被木炭吸附
C. 酒精溶于水 D. HCl气体溶于水
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 同周期的ⅡA族与ⅢA族元素的原子序数一定相差1
B. 第三周期非金属元素含氧酸的酸性从左到右依次增强
C. 元素的非金属性越强,其气态氢化物越不稳定
D. 硅位于元素周期表中金属和非金属的交界处,其单质可作半导体材料
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是( )
A. 乙酸分子的比例模型:
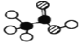
B. 原子核内有10个中子的氧原子:
C. NH4Cl的电子式:
D. 用电子式表示氯化氢分子的形成过程:
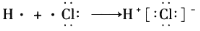
难度: 简单查看答案及解析
-
下列各图为周期表的一部分。表中数字为原子序数,其中M为37的是( )

难度: 中等查看答案及解析
-
海洋是一个巨大的宝藏,期待着人们的开发和利用,下列物质不经过化学变化就能从海水中获得的是
A. 单质溴 B. 单质镁 C. 烧碱 D. 食盐
难度: 简单查看答案及解析
-
化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时将部分化学能转化为热能
B. 电解水制氢气时将部分化学能转化为电能
C. 炸药爆炸时将部分化学能转化为动能
D. 镁条燃烧时将部分化学能转化为光能
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 由非金属原子形成的化合物一定是共价化合物
B. 离子化合物里可以存在共价键
C. 离子键、共价键、氢键均属于化学键
D. H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 浓硫酸溶于水是放热反应
C. 反应物和生成物所具有的总能量决定了放热还是吸热
D. 断开化学键放热,形成化学键吸热
难度: 简单查看答案及解析
-
下列分子或离子①F- ②Na+ ③HF ④NH3 ⑤CH4其中与氖原子含有相同电子数的是( )
A. ①②③ B. ②③④ C. ①②⑤ D. ①②③④⑤
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 碱金属单质与水反应时都能生成强碱和氢气
B. Cl2可以从NaBr水溶液中置换出溴单质,可类推F2可以从NaCl水溶液中置换出氯单质
C. 碱金属单质在空气中燃烧的生成物都是过氧化物
D. HX的还原性顺序为:HF>HCl>HBr>HI
难度: 简单查看答案及解析
-
发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(l)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
难度: 中等查看答案及解析
-
下列分子中所有原子都满足最外层8电子结构的是( )
A. NCl3 B. PCl5
C. CH3Cl D. BF3
难度: 简单查看答案及解析
-
由乙烯推测丙烯的结构或性质,正确的是( )
A. 不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
B. 分子中所有原子都在同一平面上
C. 与HCl加成只生成一种产物
D. 由丙烯之间的相互加成可得聚丙烯
难度: 简单查看答案及解析
-
乙醇分子中各种化学键如下图所示,关于乙醇在各种反应中断裂键的说法不正确的是( )
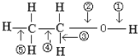
A. 乙醇完全燃烧时断键①②③④⑤
B. 乙醇和金属钠反应时断键①
C. 乙醇和浓H2SO4共热到170℃时断键②③
D. 乙醇在Ag催化下与O2反应时断键①③
难度: 简单查看答案及解析
-
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是

A. 外电路的电流方向为X→外电路→Y
B. 若两电极分别为Fe和石墨棒,则X为石墨棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极材料都是金属,则它们的活动性顺序为X>Y
难度: 中等查看答案及解析
-
实验中欲快速制得H2,以下最合适的方法是( )
A. 纯锌与稀H2SO4 B. 纯锌和浓H2SO4
C. 纯锌与稀盐酸 D. 粗锌(含铜杂质)与稀H2SO4
难度: 简单查看答案及解析
-
下列关于常见有机物的说法正确的是( )
A. 聚乙烯、聚氯乙烯、纤维素都是合成高分子化合物
B. 天然油脂的分子中含有酯基,属于酯类物质
C. 可以用加热的方法分离提纯蛋白质
D. 乙醇、乙酸、乙烯都能发生加成反应
难度: 简单查看答案及解析
-
已知C6H14有多种同分异构体,则其同分异构体中沸点最高的分子的一氯取代物的种数(不考虑立体异构)是( )
A. 2 B. 3 C. 4 D. 5
难度: 简单查看答案及解析
-
下列事实能说明氯元素原子得电子能力比硫元素强的是( )
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强
③HCl的稳定性比H2S强 ④HCl的还原性比H2S强
⑤HClO的酸性比H2SO4强
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑦Cl2能与H2S反应生成S
⑧在周期表中Cl处于S同周期的右侧 ⑨还原性:Cl-<S2-
A. ③④⑤⑦⑧⑨
B. ③⑥⑦⑧
C. ③⑥⑦⑧⑨
D. ①②③④⑤⑥⑦⑧⑨
难度: 中等查看答案及解析
-
下列除去括号内杂质的有关操作正确的是
A. 苯(硝基苯):加少量蒸馏水震荡,待分层后分液
B. 乙醇(水):加新制生石灰,蒸馏
C. CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D. 乙烷(乙烯):通入氢气发生加成反应
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示,下列有关该有机物的说法中正确的是
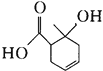
A. 能和碳酸钠溶液反应的官能团有2种
B. 1mol该有机物最多能与2molH2发生加成
C. 与
 互为同分异构体
互为同分异构体D. 既可以发生取代反应又可以发生氧化反应
难度: 中等查看答案及解析
-
下列有关能量的判断和表示方法正确的是( )
A. 由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:石墨比金刚石更稳定
B. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C. 由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ
D. 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ
难度: 简单查看答案及解析
-
燃烧a g C2H5OH(l),生成二氧化碳气体和液态水,放出的热量为Q kJ,经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则表示乙醇燃烧的热化学方程式是
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-20Q kJ·mol-1
B. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-40Q kJ·mol-1
C. C2H5OH(l)+O2(g)=CO2(g)+H2O(g) ΔH=-20Q kJ·mol-1
D. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-40Q kJ·mol-1
难度: 简单查看答案及解析