-
下列说法正确的是
①新制氯水经光照一段时间pH减小
②Al和Fe都可以利用致密的氧化膜保护内层金属不被腐蚀
③Al2O3和Fe2O3都为碱性氧化物,所以都能溶于硫酸
④pH在5.6~7.0之间的降水通常称为酸雨
A. ①② B. ②③ C. ①③ D. ③④
难度: 简单查看答案及解析
-
下列叙述中,正确的是( )
A. 硅是良好的半导体材料,且是制造光缆的主要材料
B. SiO2不溶于水,也不溶于任何酸
C. 观察K2SO4的焰色应透过蓝色的钴玻璃
D. Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中Fe也显+3价
难度: 简单查看答案及解析
-
下列说法正确的是
A. 液溴易挥发,在存放液溴的试剂瓶中应加水封
B. 铝箔燃烧后不掉落的原因是铝的熔沸点比较高
C. Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
D. 溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. SiO2是酸性氧化物,能与水反应
B. Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D. 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液无色
难度: 简单查看答案及解析
-
对于下列实验现象描述正确的是( )
A. 铁在氧气中燃烧生成红色固体
B. 镁在二氧化碳中燃烧生成白色固体
C. 将过量的NaOH溶液逐滴滴入AlCl3溶液中,先无明显现象后出现白色絮状沉淀
D. 将过量的稀盐酸逐滴滴入稀Na2CO3溶液中,开始几乎不会产生气体,后来出现大量气体。
难度: 中等查看答案及解析
-
下列有关物质的性质与应用相对应的是 ( )
A. 明矾能水解生成Al(OH)3 胶体,可用作自来水消毒剂
B. FeCl3 溶液能与Cu 反应,可用于蚀刻印刷电路
C. SO2 具有氧化性,可用于漂白纸浆
D. 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈红棕色
难度: 简单查看答案及解析
-
下列实验设计方案中,可行的是( )
A. 用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3
B. 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体
C. 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42-
D. 用加热的方法提纯含有少量碳酸钠的碳酸氢钠
难度: 中等查看答案及解析
-
下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是 ( )
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. HClO3和K2SO4 D. Na2SO3和BaCO3
难度: 简单查看答案及解析
-
下列试剂中可用于鉴别Fe2+和Fe3+的是( )
①KI淀粉溶液 ②酸性KMnO4溶液 ③KSCN溶液 ④KBr溶液
A. ①③ B. ①②③ C. ①③④ D. ①②③④
难度: 简单查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象
结论
A
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体
HNO3分解生成了NO2
B
向NaAlO2溶液中滴加AlCl3溶液,无明显现象
NaAlO2与AlCl3不反应
C
将Na加入CuSO4溶液中,生成红色沉淀
Na与CuSO4发生置换反应
D
向饱和Na2CO3中通入足量CO2,溶液变浑浊
析出了NaHCO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
解释下列事实的方程式正确的是( )
A. Al溶于NaOH溶液:Al + H2O + 2OH- ==AlO2- + 2H2↑
B. 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH- = SiO32- + H2O
C. 硫酸铝溶液中加入过量的氨水:Al3++3OH-===Al(OH)3↓
D. 铁片放入过量的稀硝酸中:3Fe+8H++2NO3- ===3Fe2++2NO↑+4H2O
难度: 简单查看答案及解析
-
向盛有少量过氧化钠固体的试管中滴加水,直到气体不再放出,加水稀释,取少量所得溶液,加入少量二氧化锰,又有气体放出,待气体不再放出后,再滴加酚酞,溶液变红。下列猜测不合理的是
A.过氧化钠和水反应生成氢氧化钠和氧气
B.过氧化钠和水反应的产物是过氧化氢和氧气
C.过氧化氢在二氧化锰催化作用下分解生成氧气和水
D.过氧化钠跟水反应生成氢氧化钠和过氧化氢
难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示的转化关系,则X、Y可能是 ( )
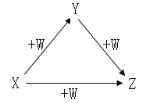
①Na、Na2O2 ②AlCl3、Al(OH)3 ③Cl2、FeCl3 ④C、CO
A. ①② B. ②③ C. ③④ D. ②④
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是 ( )
①
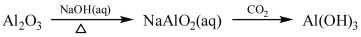
②
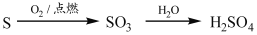
③

④

⑤
A. ①④⑤ B. ②③④ C. ②④ D. ①③
难度: 中等查看答案及解析
-
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法不正确的是

A.气体A是NO
B.X中不能确定的离子是 A13+和C1ˉ
C.溶液E和气体F能发生化学反应
D.X中肯定存在Fe2+、A13+、NH4+、SO42ˉ
难度: 困难查看答案及解析
-
下列反应过程符合如图所示关系的是 ( )

A. 向Ba(NO3)2溶液中通入SO2气体至过量
B. 向Na2SiO3溶液中通入HCl气体至过量
C. 向澄清石灰水中通入SO2气体至过量
D. 向NaAlO2溶液中通入HCl气体至过量
难度: 中等查看答案及解析
-
下列四组实验中,操作正确且能达到预期目的是
A. 配制稀硫酸
 B. 固体NaHCO3分解
B. 固体NaHCO3分解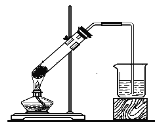
C. 制备Fe(OH)2沉淀
 D. 收集NH3
D. 收集NH3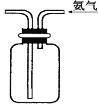
难度: 中等查看答案及解析
-
在1L氯化铁和氯化铝的混合液中,Fe3+的物质的量浓度为0.4mol/L,Cl-的物质的量浓度为1.8 mol/L。要使Fe3+全部转化为沉淀分离出来,至少需要加入 4 mol/L NaOH溶液的体积为( )
A. 450mL B. 500mL C. 300mL D. 200mL
难度: 中等查看答案及解析
-
将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.8mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A. 21.2g B. 6.2g C. 8.4g D. 10.6g
难度: 中等查看答案及解析
-
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5 mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
A. 反应后溶液中Fe3+物质的量为0.8 mol
B. 反应后产生13.44 L H2(标准状况)
C. 反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol
D. 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
难度: 简单查看答案及解析