-
用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA
D. 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L
难度: 中等查看答案及解析
-
同温同压下,ag甲气体和2ag乙气体所占的体积之比为1:2,根据阿伏加德罗定律判断,下列叙述不正确的是( )
A. 同温同压下甲和乙的密度之比为1:1
B. 甲与乙的相对分子质量之比为1:1
C. 同温同体积下等质量的甲和乙的压强之比为1:1
D. 等质量的甲和乙中的原子数之比为1:1
难度: 中等查看答案及解析
-
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是( )
硫酸 化学纯 CP 500 mL
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
A. 该硫酸的物质的量浓度为9.2 mol/L
B. 1 mol Fe与足量的该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol/L的硫酸需取该硫酸50 mL
D. 等质量的水与该硫酸混合后所得溶液的物质的量浓度大于9.2 mol/L
难度: 中等查看答案及解析
-
下列有关说法中正确的是 ( )
A.有单质生成的反应一定是氧化还原反应
B.焰色反应是元素表现出来的化学性质
C.由两种元素组成,原子个数比为1:1的物质一定是纯净物
D.能与酸反应产物中有盐和水的氧化物不一定是碱性氧化物
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 淀粉、纤维素等高分子化合物均属于纯净物
B. 非金属氧化物都是酸性氧化物
C. 食醋、纯碱、食盐分别属于酸、碱、盐
D. 丁达尔效应可用于区别溶液与胶体
难度: 中等查看答案及解析
-
在给定的四种溶液中,一定能大量共存的微粒组是( )
A. 常温下,由水电离的c(OH-)=1×10-12 mol·L-1的溶液中:Ba2+、K+、Br-、SiO32-
B. 常温下葡萄糖溶液中:SCN-、Cl-、K+、NH4+
C. 溴水中:Na+、CO32-、NH4+、SO42-
D. 常温下,pH大于7的溶液:Na+、Ba2+、SO32-、Cl-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3•H2O
难度: 中等查看答案及解析
-
将磁性氧化铁放入稀硝酸中可发生如下反应:3Fe3O4+28HNO3===9Fe(NO3)x+NO↑+14H2O,下列判断合理的是( )
A. Fe(NO3)x中x为2
B. 磁性氧化铁中的铁元素全部被氧化
C. 稀硝酸在反应中只作氧化剂
D. 反应中每生成0.4 mol还原产物,就有1.2 mol电子转移
难度: 中等查看答案及解析
-
W、X、Y是原子序数依次增大的同一短周期元素。W、X是金属元素,它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,W与Y可形成化合物W2Y。下列说法正确的是
A. Y的低价氧化物与O3漂白的原理相同
B. Y的氢化物和W2Y所含化学键的类型相同
C. 上述三种元素形成的简单离子,X离子半径最小
D. 工业上常用电解相应的盐溶液制备W、X的单质
难度: 中等查看答案及解析
-
如图所示,下列说法不正确的是( )

A. 反应过程(1)的热化学方程式为A2(g)+B2(g)===C(g) ΔH1=-Q1kJ·mol-1
B. 反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g) ΔH2=+Q2kJ·mol-1
C. Q1与Q2的关系:Q1>Q2
D. ΔH2>ΔH1
难度: 中等查看答案及解析
-
某溶液中含大量NH4+、Na+、HCO3-、CO32-、CH3COO-离子,其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
A. Na+ B. CO32-、NH4+
C. CH3COO- D. CH3COO-、Na+
难度: 中等查看答案及解析
-
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
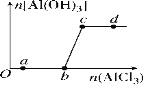
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
难度: 中等查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A. FeO B. Fe2O3 C. FeSO4 D. Fe3O4
难度: 中等查看答案及解析
-
气凝胶是一种世界上最轻的固体,世被称为“固态烟”,非常坚固耐用,它可以承受相当于自身重量几千倍的压力,最高能承受1400摄氏度的高温,绝热性能十分优越,其主要成分是二氧化硅等。下列说法正确的是( )
A. 该材料具有良好的导电性
B. 二氧化硅可用于制作光导纤维
C. 二氧化硅耐所有的酸和碱
D. 水泥的主要成分是二氧化硅
难度: 中等查看答案及解析
-
某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列有关该同学对实验原理的解释和所得结论的叙述不正确的是( )
A. 氧化性:ClO->I2>SO42—
B. 蓝色消失的原因是Na2SO3溶液具有漂白性
C. 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2使淀粉变蓝
D. 若将Na2SO3溶液加入氯水中,氯水褪色
难度: 简单查看答案及解析
-
化学与生产、生活息息相关,下列叙述错误的是( )
A. 铁表面镀锌可增强其抗腐蚀性
B. 用聚乙烯塑料代替聚乳酸塑料可减少白色污染
C. 大量燃烧化石燃料是造成雾霾天气的一种重要因素
D. 含重金属离子的电镀废液不能随意排放
难度: 简单查看答案及解析
-
利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
实验装置
A
稀硫酸
Na2S
AgNO3与AgCl的溶液
Ksp(AgCl)>Ksp(Ag2S)
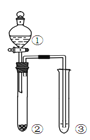
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2 溶液
SO2与可溶性钡盐均可以生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是:
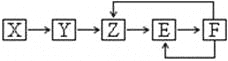
A. X可能是一种氢化物
B. 若Y为单质,Y生成Z属于化合反应
C. E可能是一种有色气体
D. F中M元素的化合价可能为+5
难度: 中等查看答案及解析