-
溶液、胶体这两种分散系的根本区别是( )
A. 是否有丁达尔现象 B. 分散质微粒直径的大小
C. 能否透过滤纸或半透膜 D. 是否均一、稳定、透明
难度: 中等查看答案及解析
-
下列诗句或成语只涉及物理变化的是 ( )
A. 爆竹声中一岁除 B. 铁杵磨成针 C. 野火烧不尽 D. 百炼成钢
难度: 简单查看答案及解析
-
下列反应不属于四种基本反应类型,但属于氧化还原反应的是 ( )
A. Fe+CuSO4=FeSO4+Cu B. 3CO+Fe2O3
2Fe+3CO2
C. AgNO3+NaCl=AgCl↓+NaNO3 D. 2KMnO4
K2MnO4+MnO2+O2↑
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为1 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,1 NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
难度: 困难查看答案及解析
-
现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为( )
A. 1∶1∶1 B. 1∶2∶3 C. 3∶2∶1 D. 6∶3∶2
难度: 简单查看答案及解析
-
依照阿伏伽德罗定律,下列叙述正确的是 ( )
A. 同温同压下两种气体的体积之比等于摩尔质量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种气体的摩尔质量之比等于密度之比
D. 同温同体积下两种气体的物质的量之比等于压强的反比
难度: 中等查看答案及解析
-
如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是( )
A.
L B.
L C.
L D.
L
难度: 中等查看答案及解析
-
下列有关摩尔质量的描述或应用中,不正确的是( )
A. 1 mol NH4+的质量为18 g·mol-1
B. SO2的摩尔质量为64 g•mol-1
C. 铝原子的摩尔质量在数值上等于它的相对原子质量
D. 一个水分子的质量约等于
g
难度: 简单查看答案及解析
-
下列溶液中溶质的物质的量浓度为1mol/L的是 ( )
A. 将40gNaOH溶解于1L水中配成NaOH溶液
B. 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液
C. 将1L0.5mol/L的浓盐酸加热浓缩为V/2L
D. 从1000ml1mol/L的NaCl溶液中取出100ml的溶液
难度: 中等查看答案及解析
-
下列溶液中Cl-浓度与50 mL 1mol.L-1 AlCl3溶液中Cl-浓度相等的是( )
A. 150 mL 1 mol·L-1的NaCl溶液 B. 75 mL 2 mol·L-1 NH4Cl溶液
C. 150 mL 3 mol·L-1的KCl溶液 D. 75 mL 1 mol·L-1的FeCl2溶液
难度: 困难查看答案及解析
-
已知R2+核外有a个电子,b个中子。表示R原子符号正确的是 ( )
A. R B.
C.
D.
难度: 中等查看答案及解析
-
核内中子数为N的R2+,质量数为A,则ng它的氧化物中所含质子的物质的量为( )
A. n(A-N+8)/(A+16)mol B. n(A-N+10)/(A+16)mol
C. n(A-N+6)/A mol D. (A—N+2)mol
难度: 困难查看答案及解析
-
下列说法正确的是 ( )。
A. 液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质
B. NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C. 蔗糖、酒精在水溶液里和熔融状态时均不导电,所以它们是非电解质
D. 铜、石墨均导电,所以它们是电解质
难度: 中等查看答案及解析
-
某同学在实验报告中有以下实验数据:①用托盘天平称取11.7 g食盐;②用量筒量取5.26 mL盐酸;③用广泛pH试纸测得溶液的pH值是3.5,其中数据合理的是 ( )
A. ① B. ②③ C. ①③ D. ②
难度: 中等查看答案及解析
-
在生活、生产及化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行区别、检验等。下列说法正确的是( )
A. 用KOH溶液可以将NH4Cl、NaCl、CuSO4、FeCl3四种溶液区别开
B. C、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开
C. 某溶液中加入稀盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,则此溶液中一定含有CO32¯
D. 可以用BaCl2溶液和稀硝酸检验Na2SO3是否变质
难度: 困难查看答案及解析
-
在相同条件下,两个体积相等的容器,一个充满二氧化氮气体,另一个充满氮气和氧气的混合气体,这两个容器内一定具有相同的
A. 原子总数 B. 质子总数 C. 分子总数 D. 质量
难度: 中等查看答案及解析
-
下列有关化学实验基本知识和基本操作的描述不正确的是 ( )
A. 丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体
B. 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的NH4+
C. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,不一定有Ca2+
D. 先加入BaCl2溶液,再加入盐酸,产生了白色沉淀,则溶液中一定含有大量的SO42-
难度: 中等查看答案及解析
-
完成下列实验所需选择的装置或仪器都正确的是 ( )
A
B
C
D
实验
分离植物油和氯化钠溶液
除去氯化钠晶体中混有的氯化钾晶体
分离CCl4中的Br2
除去CO2气体中的HCl气体
装置
或仪器
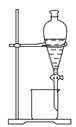
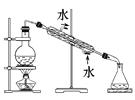
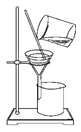

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知Q与R的摩尔质量之比为9:22,在反应X+2Y===2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量之比为
A. 46∶9 B. 16∶9 C. 7∶3 D. 32∶9
难度: 困难查看答案及解析
-
将标准状况下的 aL HCl气体溶于1000g水中,得到盐酸密度为b g/cm3,则该盐酸的物质的量浓度是( )
A.
B.
C.
D.
难度: 极难查看答案及解析


