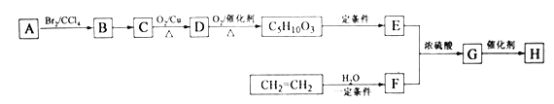
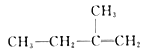-
化学是你,化学是我,化学深入我们生活,下列说法正确的是
A. 木材纤维和土豆淀粉遇碘水均显蓝色
B. 食用花生油和鸡蛋清都能发生水解反应
C. 包装用材料聚乙烯和聚氯乙烯都属于烃
D. PX项目的主要产品对二甲苯属于饱和烃
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值。下列说法正确的是
A. 标准状况下,11.2L苯中含有分子的数目为0.5NA
B. 常温常压下,1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
C. 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子数目为0.4NA
D. 25℃时,pH=13的氢氧化钠溶液中含有OH-的数目为0.1NA
难度: 中等查看答案及解析
-
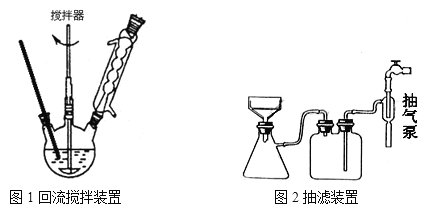
下列有关实验正确的是

A. 图甲装置用于Cu和浓硫酸反应制取少量的SO2气体
B. 图乙装置用于灼烧Al(OH)3
C. 图丙装置用于检验浓硫酸与蔗糖反应产生的SO2
D. 图丁装置用于实验室制备乙酸乙酯
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
蘸有浓氨水的玻璃棒靠近某溶液
有白烟产生
该溶液可能是浓盐酸
B
将SO2通入硝酸钡溶液
产生白色沉淀
SO2与可溶性钡盐均生成白色沉淀
C
向Zn与稀硫酸反应的溶液中滴加硫酸铜溶液
产生气体的速率加快
硫酸铜作该反应的催化剂
D
用铂丝蘸取少量某溶液进行焰色反应
火焰呈黄色
该溶液一定是钠盐溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
以一个丁基(-C4H9)取代联三苯(
)分子中的一个氢原子,所得的同分异构体数目为
A. 18 B. 28 C. 24 D. 20
难度: 中等查看答案及解析
-
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
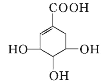
莽草酸
A. 分子式为C7H6O5 B. 分子中含有2种官能团
C. 可发生加成和取代反应 D. 在水溶液中羧基和羟基均能电离出H+
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,p、q、r、s 是上述四种元素形成的二元化合物,其中r是一种中学常见的两性氧化物,s是一种强酸,r与s的水溶液反应生成p与q。下列说法错误的是
A. 简单离子半径:W>Y>Z B. 气态氢化物的沸点:Y>W
C. Y与W可以形成多种二元化合物 D. p、q与r的化学键类型完全相同
难度: 简单查看答案及解析