-
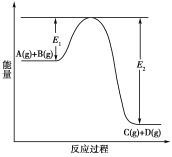
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.
 B.
B. 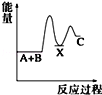
C.
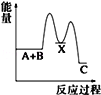 D.
D. 
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率
B. 在可逆反应里,正反应的化学反应速率是正值,逆反应的化学反应速率是负值
C. 在同一化学反应里,其化学反应速率可以用反应物浓度的改变来表示,也可以用生成物浓度的改变来表示,其数值可能相同,也可能不相同
D. 化学反应速率的单位可以是g/(L·s),也可以是kg/(L·s),甚至可以用t/(L·s)等来表示
难度: 中等查看答案及解析
-
在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)[mol·(L·s)-1]来表示,且v(A)、v(B)、v(C)之间有以下关系:v(B)=3v(A), 3v(C)=2v(B)。则此反应可表示为 ( )
A. 2A+3B
2C B. A+3B
2C
C. 3A+B
2C D. A+B
C
难度: 中等查看答案及解析
-
已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g)
2NH3(g)
起始浓度/mol·L-1 1.0 3.0 0.2
2s末浓度/mol·L-1 0.6 1.8 1.0
4s末浓度/mol·L-1 0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是 ( )
A. 2s末氨气的反应速率=0.4mol·(L·s)-1
B. 前2s时间内氨气的平均反应速率=0.4mol·(L·s)-1
C. 前4s时间内氨气的平均反应速率=0.3mol·(L·s)-1
D. 2~4s时间内氨气的平均反应速率=0.2mol·(L·s)-1
难度: 中等查看答案及解析
-
在带有活塞的密闭容器中发生反应:Fe2O3+3H2===2Fe+3H2O(g),采取下列措施能改变反应速率的是( )
A. 增加Fe2O3的量 B. 保持容器体积不变,增加H2输入量
C. 减少Fe的量 D. 保持容器体积不变,增加H2O(g)
难度: 简单查看答案及解析
-
可逆反应 A(气) + nB(气)
2C(气) (正反应吸热)在一定温度下,反应物 B 的转化率与压强有如图所示的关系,那么 n 值一定是( )

A. >1 B. ≥ 1 C. 1 D. 2
难度: 中等查看答案及解析
-
下列方法中可以说明2HI(g)
H2(g)+I2(g)已达到平衡的是:①单位时间内生成n mol H2的同时生成n mol HI;②一个H–H键断裂的同时有两个H–I键断裂;③百分组成ω(HI)=ω(I2);④反应速率υ(H2)=υ(I2)=1/2υ(HI)时;⑤ c(HI):c(H2):c(I2)=2:1:1时;⑥温度和体积一定时,容器内压强不再变化;⑦温度和体积一定时,某一生成物浓度不再变化;⑧条件一定,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体的颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化。( )
A. ②③⑤ B. ①④⑦ C. ②⑦⑨ D. ⑧⑨⑩
难度: 困难查看答案及解析
-
已知下列热化学方程式:2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol
H2(g)+
O2(g)===H2O(g);ΔH=-241.8 kJ/mol
H2(g)+
O2(g)===H2O(l);ΔH=-285.8 kJ/mol
则氢气的燃烧热为
A. 438.6 kJ/mol B. 241.8 kJ/mol C. 285.8 kJ/mol D. 无法确定
难度: 中等查看答案及解析
-
已知:H2(g)+
O2(g)===H2O(g);ΔH=-Q1 kJ·mol-1
2H2(g)+O2(g)===2H2O(l);ΔH=-Q2 kJ·mol-1
则下列判断正确的是 ( )
A. 2Q1>O2 B. Q1>2Q2 C. 2Q1<Q2 D.
Q2=Q1
难度: 中等查看答案及解析
-
下列关于外界条件的改变对化学反应速率影响的说法中正确的是( )
A. 升高温度能加快吸热反应速率,减慢放热反应速率
B. 增大压强能加快气体体积缩小方向的反应速率,减慢气体体积增大方向的反应速率
C. 若外界条件的改变引起了正、逆反应速率的改变,就一定能引起化学平衡的移动
D. 压强的改变只有通过浓度的改变才能影响化学反应速率
难度: 中等查看答案及解析
-
对放热反应:A+B===C+D,以下说法一定正确的是(EA、EB、EC、ED分别表示物质A、B、C、D所具有的能量)( )
A. EA>EB B. EA>EB+EC
C. EA+EB>EC+ED D. EA+EB<EC+ED
难度: 简单查看答案及解析
-
根据图中包含的信息分析,下列叙述正确的是( )
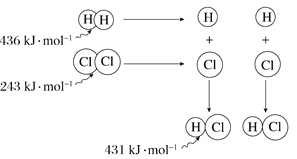
A. 氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B. 436 kJ·mol-1是指断开1 mol H2中的H-H键需要放出436 kJ的能量
C. 氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D. 431 kJ·mol-1是指生成2 mol HCl中的H—Cl键需要放出431 kJ的能量
难度: 中等查看答案及解析
-
下列关于反应热的说法正确的是( )
A. 当△H为“-”时,表示该反应为吸热反应
B. 已知C(s)+1/2O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
难度: 中等查看答案及解析