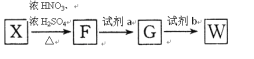
-
下列说法正确的是
A. 植物油氢化过程中发生了加成反应
B. 淀粉和纤维素互为同分异构体
C. 环己烷与苯可用酸性KMnO4溶液鉴别
D. 水可以用来分离溴苯和苯的混合物
难度: 中等查看答案及解析
-
分子式为C4H2Cl8的同分异构体共有(不考虑立体异构)
A. 10种 B. 9种 C. 8种 D. 7种
难度: 中等查看答案及解析
-
下列根据实验操作和现象得出的结论正确的是
实验操作
实验现象
结论
A
将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液
溶液变成血红色
Fe(NO3)2试样已变质
B
向甲苯中滴加少量酸性髙锰酸钾溶液
高锰酸钾溶液褪色
甲苯发生了氧化反应
C
常温下分别测定浓度均为0.1mol/L的Na2SiO3溶液和Na2CO3溶液的pH
pH:Na2SiO3>Na2CO3
非金属性:Si>C
D
将少量某无色气体通入澄清石灰水中
出现白色沉淀
该气体一定是CO2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,足量的铜与一定量浓硝酸反应,每生成224 mL气体,转移电子数目为0.01NA
B. 一定条件下,一定量的氧气通过Na单质后,Na单质增重3.2 g,转移电子数目为0.4NA
C. 0.1mol/L的CH3COONa溶液中所含碳原子总数为0.2NA
D. 4 g SiC 中所含碳硅键数目为0.4NA
难度: 中等查看答案及解析
-
《物理小识》中对镀金法有如下叙述:“以汞和金涂银器上,成白色,入火则汞去,而金存,数次即黄。”其中“入火则汞去”是指
A. 蒸发 B. 升华 C. 分液 D. 分馏
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
B. 金属钠具有强还原性,可用于与TiCl4溶液反应制取金属Ti
C. Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚
D. FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 钠与水反应:Na +2H2O=Na++2OH–+H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O
H2↑+Cl2↑+2OH–
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O
难度: 中等查看答案及解析
-
有关铁及其化合物的说法正确的是
A. 将NaOH浓溶液滴加到饱和的FeCl3溶液中,制备Fe(OH)3胶体
B. SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
难度: 简单查看答案及解析
-
常温下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/c(OH﹣) =1×10-12的溶液中:K+、Na+、
、
C. c(Fe2+)=1 mol•L-1的溶液中:K+、
、
、
D. 能使甲基橙变红的溶液中:Na+、
、
、
难度: 中等查看答案及解析
-
汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
难度: 中等查看答案及解析
-
下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验①
实验②
实验③



A. 实验①中生成的沉淀是BaCO3
B. 实验①中有气体生成
C. 实验②沉淀中可能含有BaSO4
D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+
难度: 困难查看答案及解析
-
下列有关有机物的说法正确的是
A. 苯、四氯化碳、裂化汽油都可以用来萃取溴水中的溴
B. 分子式为C4H6Cl2O2含羧基的有机物可能有6种(不考虑立体异构)
C. 总质量一定时,乙酸和葡萄糖无论以何种比例混合完全燃烧消耗氧气的量均相等
D. HOCH2COOH一定条件下可与O2、NaHCO3溶液、乙醇、乙酸发生反应,且反应类型相同
难度: 中等查看答案及解析
-
离子甲与微粒乙在溶液中的转化关系如下图所示,则离子甲不可能是( )
A. HCO3- B. NH4+ C. Al3+ D. Mg2+
难度: 中等查看答案及解析
-
已知
(x)、
(y)、
(z) 互为同分异构体,下列说法不正确的是
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原子可能处于同一平面
C. x的同分异构体只有y和z两种
D. x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
难度: 中等查看答案及解析
-
用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是

A. ab段H+被还原,溶液的pH增大
B. cd段相当于电解水
C. c点时加人适量CuCl2固体,电解液可恢复原来浓度
D. 原溶液中KCl和CuSO4的物质的量浓度之比为2:1
难度: 困难查看答案及解析
-
“银针验毒”在我国有上千年历史,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:4Ag+2H2S+O2=2Ag2S+2H2O。当银针变色后,将其置于盛有食盐水的铝制容器中一段时间后便可复原。以下说法不正确的是
A. 当银针变黑时,所检验的物质有毒
B. 银针验毒时,Ag被氧化
C. 上述验毒反应的氧化产物和还原产物的物质的量之比为1∶1
D. 银针复原发生的反应可能为:3Ag2S+2Al=6Ag+Al2S3
难度: 困难查看答案及解析
-
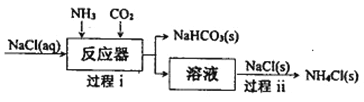
由硫铁矿(主要成分:FeS2 和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
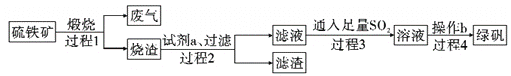
下列说法不正确的是
A. 过程1废气中含SO2
B. 过程2试剂a 为稀硫酸
C. 过程3离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
难度: 困难查看答案及解析
-
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是
A. 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+
B. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+
C. 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3
D. 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
难度: 中等查看答案及解析
-
在标准状况下,在三个干燥的烧瓶内分别装有纯净的NH3,含一半空气的HCl气体, NO2 和O2的混合气体[V(NO2)∶V(O2) = 4∶1 ],然后分别作喷泉实验,三个烧瓶内所得溶液的物质的量浓度之比为
A. 2∶1∶2 B. 5∶5∶4 C. 1∶1∶1 D. 无法确定
难度: 简单查看答案及解析
-
在某稀硝酸中加入5.6 g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2 g,则所得溶液中Fe2+和Fe3+的物质的量之比为
A. 3∶2 B. 2∶1 C. 1∶1 D. 4∶1
难度: 中等查看答案及解析
-
中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是

A. 吸收塔中的反应为2NO+2S2O42—+2H2O=N2+4HSO3—
B. 电解池中质子从电极I向电极Ⅱ作定向移动
C. 电极I为阴极,电极反应式为2H2O+2e—=2OH—+H2↑
D. 每处理1 mol NO,电解池质量减少16g
难度: 困难查看答案及解析
-
已知:还原性HSO3—>I—,氧化性IO3—>I2。在含3molNaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是
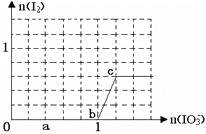
A. 0~a间发生反应:3HSO3—+IO3—=3SO42-+I—+3H+
B. a~b间共消耗NaHSO3的物质的量为1.8mol
C. b~c间反应:I2仅是氧化产物
D. 当溶液中I-与I2的物质的量之比为5∶3时,加入的KIO3为1.1mol
难度: 中等查看答案及解析
-
某无色溶液中含有Mg2+、Al3+、Fe3+、Cu2+、NH4+、Na+中的一种或几种,取100mL该溶液,向其中不断滴加NaOH溶液,产生的沉淀随着NaOH体积变化的关系如图所示,则下列叙述不正确的是
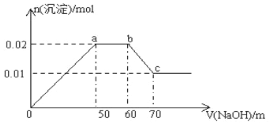
A. 该溶液中一定不含Fe3+、Cu2+
B. 该溶液中一定含有Mg2+、Al3+、NH4+,且三者物质的量浓度之比为1∶1∶1
C. 所加NaOH溶液物质的量浓度为0.1mol/L
D. a点到b点,发生的化学反应:NH4++ OH—=NH3·H2O
难度: 中等查看答案及解析
-
取Cu、Cu2O和CuO固体混合物,将其分成两等份,一份用足量的氢气还原,反应后固体质量减少6.40g,另一份加入1000mL稀硝酸,固体恰好完全溶解,收集到标准状况下NO气体4.48L,所用硝酸的物质的量浓度为
A. 3.2mol/L B. 1.6mol/L C. 0.9mol/L D. 无法判断
难度: 中等查看答案及解析
-
在密闭容器中将2molNaHCO3(s)和一定量Na2O2混合,在加热条件下让其充分反应,150℃下所得气体仅含2种组分,反应后固体的物质的量(n)的取值范围是
A. n≥1 B. 1<n<2 C. 2≤n<4 D. n≥4
难度: 简单查看答案及解析

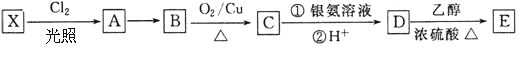
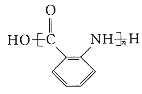 的单体。
的单体。