-
下列说法中正确的是
A. 在化学反应过程中,发生物质变化的同时不一定发生能量变化
B. 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应
C. 生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
D. ΔH的大小与热化学方程式的计量系数无关
难度: 中等查看答案及解析
-
在2A+B
3C+4D中,表示该反应速率最快的是( )
A. υ(A) = 0.5mol·L-1·S-1 B. υ(B) =" 0.3" mol·L-1·S-1
C. υ(C) = 0.8mol·L-1·S-1 D. υ(D)=" 1" mol·L-1·S-1
难度: 中等查看答案及解析
-
一定温度下,浓度均为1 mol/L的A2和B2两种气体,在密闭容器内反应生成气体C,反应达平衡后,测得:c(A2)=0.58 mol/L,c(B2)=0.16 mol/L,c(C)=0.84 mol/L,则该反应的正确表达式为( )
A. 2A2+B2
2A2B B. A2+B2
2AB
C. A2+B2
A2B2 D. A2+2B2
2AB2
难度: 中等查看答案及解析
-
下列各组变化中,前者小于后者的是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)═2H2O(l) ΔH1
H2(g)+
O2(g)===H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时分别反应放出的热量
④CaCO3(s)===CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A. ①②③ B. ②④ C. ②③④ D. ③④
难度: 困难查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2
Cd+2NiOOH+2H2O,由此可知,该电池充电时的阴极材料是
A. Cd(OH)2 B. Ni(OH)2 C. Cd D. NiOOH
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 若单位时间内生成x mol NO的同时消耗x mol NH3,则反应达到平衡状态
B. 达到化学平衡时,4v正(O2)=5v逆(NO)
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
难度: 中等查看答案及解析
-
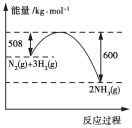
断开1 mol AB(g)分子中的化学键,使其分解生成气态A原子和气态B原子时所吸收的能量称为A—B键的键能。已在H—H键的键能为436 kJ·mol-1,H—N键的键能为391 kJ·mol-1,根据热化学方程式N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1,推求N≡N键的键能是( )
A. 431 kJ·mol-1 B. 946 kJ·mol-1
C. 649 kJ·mol-1 D. 1130 kJ·mol-
难度: 中等查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法错误的是( )
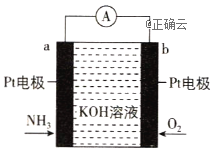
A. 溶液中OH-向电极a移动
B. 电极b上发生还原反应
C. 负极的电极反应为2NH3-6e-+6OH-
N2+6H2O
D. 理论反应消耗的NH3与O2的物质的量之比为3:4
难度: 中等查看答案及解析
-
已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
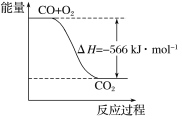
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
乙醇的燃烧热为ΔH1,甲醇的燃烧热为ΔH2,且ΔH1<ΔH2,若乙醇和甲醇的混合物1 mol完全燃烧,反应热为ΔH3,则乙醇和甲醇的物质的量之比为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A.
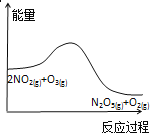 升高温度,平衡常数减小
升高温度,平衡常数减小B.
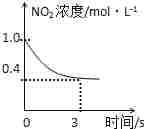 0-3s内,反应速率V (NO2)=0.2 mol•L-1
0-3s内,反应速率V (NO2)=0.2 mol•L-1C.
t1时仅加入催化剂,平衡正向移动
D.
达到平衡时,仅改变X,则X为C(O2)
难度: 中等查看答案及解析
-
一定温度下,向某密闭容器中加入0.2 mol CO和0.2 mol H2O,发生反应CO(g)+H2O(g)
CO2(g)+H2(g),4 min时反应达到平衡状态,测得,n(CO)∶n(CO2)=3∶2,下列说法正确的是( )
A. 缩小容器的体积,混合气体的密度不变
B. v(CO)=v(CO2)时,表明反应达到平衡状态
C. 平衡时CO和H2O的转化率相等
D. 无法计算该条件下反应的化学平衡常数
难度: 中等查看答案及解析
-
已知:在300 K时,A(g)+B(g)
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是( )
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C
③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化 ⑦A、B、C的分子数之比为1∶1∶2
A. ②⑤ B. ④⑦ C. ②③ D. ④⑥
难度: 中等查看答案及解析
-
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
难度: 简单查看答案及解析
-
密闭容器中进行的反应为 X(g)+3Y(g)
2Z(g),X、Y、Z 的起始浓度依次为0.1 mol / L,0.3 mol / L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是 ( )
A. X=0.2 mol / L,Y=0.6 mol / L B. Y=0.5 mol / L或Y=0.1 mol / L
C. Y=0.6 mol / L D. Z=0.4 mol / L
难度: 中等查看答案及解析