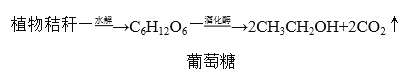
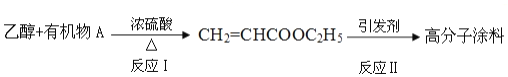-
下列有关电池的说法不正确的是( )
A. 手机上用的锂离子电池属于二次电池
B. 锌锰干电池中,锌电极是负极
C. 氢氧燃料电池可把化学能转化为电能
D. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
难度: 简单查看答案及解析
-
下列由实验得出的结论正确的是( )
实验
结论
A.
某有机物完全燃烧,只生成CO2和H2O
该有机物属于烃类物质
B.
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C.
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性强于于碳酸的酸性
D.
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生产的氯甲烷具有酸性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
化学与生活、社会密切相关,下列说法不正确的是( )
A. 淀粉除做食物外,主要用来生产葡萄糖和酒精
B. 海水淡化能解决淡水供应危机,利用离子交换法可以使海水淡化
C. 正丁烷、异丁烷的沸点依次降低
D. 糖类、蛋白质、脂肪是人体必需的营养物质。它们一定条件下都能发生水解和氧化反应
难度: 简单查看答案及解析
-
下列化学用语或模型图正确的是
A. 氮气的结构式:
B. 用电子式表示溴化氢的形成过程为:
C. CO2的比例模型:
D. 14C的原子结构示意图
难度: 简单查看答案及解析
-
下列过程不涉及化学变化的是( )
A. 用铁矿石炼铁 B. 用糯米酿甜酒 C. 石油分馏 D. 海水提溴
难度: 简单查看答案及解析
-
一定温度下反应N2+O2
2NO在密闭容器中进行,下列措施不改变化学反应速率的是
A. 缩小体积使压强增大 B. 恒容,充入N2
C. 恒容,充入He D. 恒压,充入He
难度: 中等查看答案及解析
-
短周期主族元素Ⅹ、Y、Z、W的原子序数依次增大,Ⅹ、W同主族且W原子核电荷数等于X原子核电荷数的2倍,Y、Z原子的核外电子数之和与Ⅹ、W原子的核外电子数之和相等。下列说法中一定正确的是
A. Ⅹ的原子半径比Y的原子半径大
B. Ⅹ形成的氢化物分子中不含非极性键
C. Z、W的最高价氧化物对应的水化物是酸
D. Y单质与水反应,水可能作氧化剂也可能作还原剂
难度: 中等查看答案及解析
-
下列与有机物有关的说法,错误的是( )
A. 石油的裂化和裂解属于化学变化而煤的液化、气化属于物理变化
B. 甲烷、苯、乙酸乙酯、油脂都可以发生取代反应
C. 鸡蛋清溶液中加入饱和硫酸铵会产生白色沉淀,该沉淀还可以重新溶解于水中
D. “地沟油”禁止食用,但可以用来制肥皂
难度: 简单查看答案及解析
-
下列说法不正确的是
①N2H4分子中既含极性键又含非极性键
②若R2-和M+的电子层结构相同,则原子序数:R>M
③F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤固体融化成液体的过程是物理变化,所以不会破坏化学键
⑥HF分子很稳定是由于HF分子之间能形成氢键
⑦Na2O2固体中的阴离子和阳离子个数比是1∶2
⑧由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
A. ②⑤⑥⑧ B. ①③④⑤ C. ②④⑤⑦ D. ③⑤⑦⑧
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,常温下它们的单质有一种固体和三种气体。由这四种元素中的一种或两种组成的三种有色物质与水发生氧化还原反应时,水既不作氧化剂也不作还原剂。下列说法正确的是
A. 简单气态氢化物的沸点:W>Y
B. 原子半径:r(Z)>r(W)>r(X)>r(Y)
C. 这三种有色物质与水反应后,所得溶液均呈酸性
D. X、Y、W分别与氢元素形成的化合物中化学键均为极性共价键
难度: 简单查看答案及解析
-
从金属利用的历史看,先是青铜器时代,而后是铁器时代,铝的冶炼是近百年的事,决定金属使用年代先后顺序的关键因素是( )
A. 金属的活动性 B. 金属的导电性
C. 金属的延展性 D. 地壳中金属元素的含量
难度: 简单查看答案及解析
-
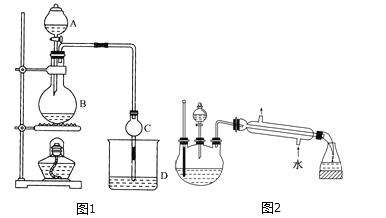
某学生在实验室制取乙酸丁酯(已知乙酸丁酯的沸点124~126℃,乙酸的沸点118℃反应温度115~125℃),其反应装置应选择( )
A.
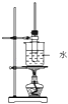 B.
B. 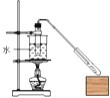
C.
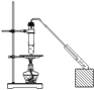 D.
D. 
难度: 困难查看答案及解析
-
氨基甲酸铵分解反应为NH2COONH4(s)
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
难度: 简单查看答案及解析
-
下列物质能使酸性高锰酸钾溶液褪色的是:①天然气;②焦炉气;③酒精;④花生油;⑤裂化汽油;⑥聚乙烯
A. ②③④⑤ B. ②④⑤ C. ③④⑤⑥ D. ①②④⑤
难度: 简单查看答案及解析
-
利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2=2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示,下列说法中错误的是( )
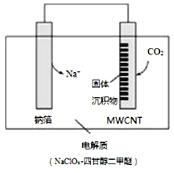
A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-=2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mole-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
难度: 中等查看答案及解析
-
对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间
水样
0
5
10
15
20
25
I (pH=2)
0.40
0.28
0.19
0.13
0.10
0.09
II(pH=4)
0.40
0.31
0.24
0.20
0.18
0.16
Ⅲ(pH=4)
0.20
0.15
0.12
0.09
0.07
0.05
IV(pH=4,含 Cu2+)
0.20
0.09
0.05
0.03
0.01
0
下列说法不正确的是( )
A. 在0~20 min内,I中M的平均分解速率为0.015mol·L-1·min-1
B. 其它条件相同时,水样酸性越强,M的分解速率越快
C. 在0~25 min内,Ⅲ中M的分解百分率比II大
D. 由于Cu2+存在,IV 中M的分解速率比I快
难度: 困难查看答案及解析
-
从柑橘中可提炼得1,8萜二烯(
).下列有关它的说法正确的是( )
A. 分子式为C10H14
B. 属于烃,难溶于水,可用某些有机溶剂提取1,8萜二烯
C. 与酸性高锰酸钾溶液、氧气、溴水等均可发生氧化反应
D. 它的一种同分异构体的结构中可能含有苯环
难度: 简单查看答案及解析
-
下列实验方案不合理的是( )
A. 可以用酸性高锰酸钾除去甲烷中的乙烯
B. 分离苯和硝基苯的混合物,可用蒸馏法
C. 可用氢氧化钠溶液将溴苯中的溴除去
D. 可用水来鉴别苯、乙醇、四氯化碳
难度: 简单查看答案及解析