-
化学与生产和生活密切相关,下列有关说法正确的是
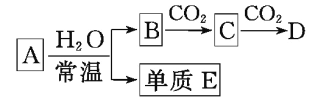
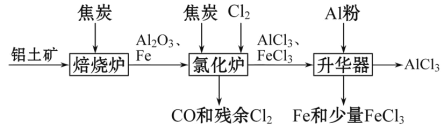
A. 刚玉(Al2O3)硬度仅次于金刚石,熔点也相当高,刚玉坩埚可用于熔融碳酸钾
B. “火树银花”的烟花场景利用的是金属的颜色反应
C. 石油分馏可得到乙烯、丙烯、丁二烯等短链烃
D. 盐析可提纯蛋白质,并保持其生理活性
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中不正确的是
A. 某密闭容器中盛有0.2 mol SO2和0.1 mol O2,一定条件下充分反应,生成SO3分子数小于0.2 NA
B. 一定条件下,2.3 g Na与O2完全反应生成3.6 g产物时失去的电子数0.1 NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为 0.1 NA
D. 20g D2O中含有的质子数为10 NA
难度: 中等查看答案及解析
-
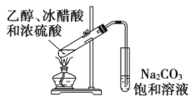
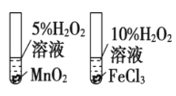
下列装置能达到实验目的的是
A. 实验室制备乙酸乙酯
B. 比较不同催化剂对化学反应速率的影响
C. 比较硫、碳、硅三种元素的非金属性

D. 验证苯和液溴发生取代反应
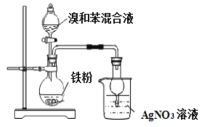
难度: 中等查看答案及解析
-
已知有机物A、B之间存在转化关系:A(C6H12O2) + H2O
B + HCOOH(已配平)则符合该反应条件的有机物B有(不含立体异构)
A. 6种 B. 7种 C. 8种 D. 9种
难度: 中等查看答案及解析
-
下列实验操作、实验现象和实验结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
将Al2(SO4)3溶液和NaHCO3溶液混合
产生白色沉淀,并有大量气体生成
生成Al2(CO3)3沉淀和CO2气体
B
在淀粉溶液中加入几滴稀硫酸,水浴5min,加入NaOH溶液调溶液pH至碱性,再加入新制的Cu(OH)2悬浊液,加热
有红色沉淀生成
淀粉完全水解
C
将少量SO2气体通过足量Na2O2
余下气体能使带火星木条复燃
有O2生成
D
用pH试纸分别测定等浓度的A、B两溶液(可能为NaHCO3或者Na2CO3)的pH值
pHA> pHB
A溶液为Na2CO3溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700 -900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
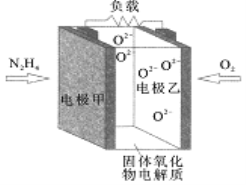
A. 电极甲发生还原反应
B. 电池内的O2-由电极乙移向电极甲
C. 电池总反应为N2H4 +2O2= 2NO +2H2O
D. 当甲电极上有lmol N2H4消耗时,乙电极上有22.4L O2参与反应
难度: 中等查看答案及解析
-
将标准状况下2.24 L CO2缓慢通入1 L 0.15 mol·L-1的NaOH溶液中,气体被充分吸收,下列关系不正确的是( )
A. 混合溶液溶质为NaHCO3和Na2CO3
B. c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
C. c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D. 加热蒸干所得混合溶液,最终得到Na2CO3固体
难度: 中等查看答案及解析