-
《神农本草经》说:“水银熔化(加热)还复为丹”;《黄帝九鼎神丹经》中的“柔丹”、“伏丹”,都是在土釜中加热Hg制得的。这里的“丹”是指
A. 氯化物 B. 合金 C. 硫化物 D. 氧化物
难度: 简单查看答案及解析
-
关于氧化剂的叙述正确的是
A. 分子中不一定含有氧元素 B. 分子中一定含有氧元素
C. 在反应中易失电子的物质 D. 是反应生成的物质
难度: 中等查看答案及解析
-
下列溶液中,跟100 mL 0.5mol•L -1 NaCl溶液所含的Cl-物质的量浓度相同的是
A. 100 mL0.5mol•L-1 MgCl2溶液 B. 200 mL1mol•L-1 CaCl2溶液
C. 50 mL1mol•L-1 NaCl溶液 D. 25 mL0.5mol•L-1 HCl溶液
难度: 简单查看答案及解析
-
下列有关溶液配制的说法正确的是
A. 在50mL量筒中配制0.1000mol•L﹣1碳酸钠溶液
B. 仅用烧杯、量筒、玻璃棒就可以配制100mL0.1000mol•L﹣1K2Cr2O7溶液
C. 用100mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100mLpH=2的盐酸
D. 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余液体吸出
难度: 中等查看答案及解析
-
下列物质分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、四氯化碳均为电解质
D. 漂白粉、水玻璃、氨水均为混合物
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2.0gH218O与D2O的混合物中所含中子数为NA
B. 常温常压下,4.4g乙醛所含σ键数目为0.7NA
C. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D. 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
2017年九寨沟发生了7.0级地震灾害,卫生医疗队赴前线展开救援,使用的下列消毒药品中属于强电解质的是( )
A. 酒精 B. 高锰酸钾 C. 碘酒 D. 食醋
难度: 中等查看答案及解析
-
将4.0 g氢氧化钠固体分别加入下列100 mL溶液中,溶液的导电能力变化不大的是( )
①自来水 ②3.65 g HCl ③6.0 g醋酸 ④5.35 g NH4Cl
A. ①② B. ②③ C. ③④ D. ②④
难度: 中等查看答案及解析
-
不用其他试剂就可以鉴别:①Ba(NO3)2;②AgNO3;③NaCl;④CuCl2,则鉴别出的先后顺序为( )
A. ①③②④ B. ③②④① C. ②③①④ D. ④②③①
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 水电离的c( H+)= 1xl0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42-
B. 能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl-
C.
=lxl0-13 moI/L的溶液中:Ba2+、ClO-、Cl-、NO3-
D. 能与铝反应放出H2的溶液中:K+、Fe2+、SO42-、Cl-
难度: 困难查看答案及解析
-
下列反应的离子方程式正确的是( )
A. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全2Al3++ 3SO42-+3Ba2++6OH- ===3BaSO4↓+2Al(OH)3↓
B. 铝溶于氢氧化钠溶液:Al+2OH-+H2O===AlO2- +2H2↑
C. 钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+
D. VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O === Mn2++5VO2++2H+
难度: 中等查看答案及解析
-
已知某物质X能发生如下转化:
下列有关上述转化关系中物质及其反应的叙述错误的是( )
A. 若X为N2或NH3,则A为硝酸
B. 若X为S或H2S,则A为硫酸
C. 若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D. 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又能絮凝净水的水处理剂。工业制备高铁酸钾的离子方程式为Fe(OH)3+ClO-+OH-
FeO42- +Cl-+H2O(未配平),下列有关说法不正确的是 ( )
A. 由上述反应可知,Fe(OH)3的氧化性强于FeO42-
B. 高铁酸钾中铁显+6价
C. 上述反应氧化剂和还原剂的物质的量之比为3∶2
D. K2FeO4处理水时,不仅能消毒、杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
难度: 困难查看答案及解析
-
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是( )
A. Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原
B. CuI既是氧化产物又是还原产物
C. 每生成1 mol CuI,有12 mol KI发生氧化反应
D. 每转移1.1 mol电子,有0.2 mol IO3-被氧化
难度: 困难查看答案及解析
-
关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A. 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在
B. 通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
C. 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO
存在
D. 加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO
存在
难度: 中等查看答案及解析
-
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化曲线如图所示.有关说法不正确的是( )
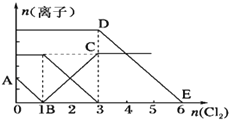
A. 线段BC代表Fe3+的物质的量的变化情况
B. 原混合溶液中c(FeBr2)=6 mol/L
C. 当通入 2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-
D. 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3
难度: 中等查看答案及解析