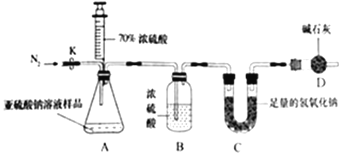
-
下列说法:①二氧化硫和臭氧都是空气污染物;②洁净的空气和水都是纯净物;③因为水体有自净能力,所以生活污水可任意排放;④降低可燃物的着火点是灭火的途径之一;⑤烧碱和熟石灰的溶液都显碱性;⑥复合肥中一定要含有氮、磷、钾三种元素;⑦如果将化合物按有机化合物和无机化合物两大类划分,则葡萄糖和尿素应属于有机化合物。其中正确的是
A. ①⑤⑦ B. ①②④⑥ C. ④⑤⑦ D. ①②⑤⑥
难度: 简单查看答案及解析
-
逻辑推理是学习化学常用的思维方法,下列推理正确的是
A. 有机物都含有碳元素,所以含有碳元素的化合物一定是有机物
B. 一氧化碳从氧化铁中还原出铁,所以冶炼金属一定要用一氧化碳
C. 铁在潮湿的空气中容易生锈,所以隔絶氧气和水一定可以防止铁生锈
D. 化学反应通常有能量变化,所以人类利用的能量都是由化学反应提供
难度: 中等查看答案及解析
-
下列做法与“创建卫生城市,建设水绿盐城” 不吻合的是( )
A. 植树种草 B. 就地焚烧垃圾
C. 节能减排 D. 公共场所禁止吸烟
难度: 简单查看答案及解析
-
将铝粉和氧化铜混合加热,反应的化学方程式为3CuO+2Al═3Cu+Al2O3.充分反应后,为了检验氧化铜是否剩余,取少量反应后的固体,加入足量稀硫酸,充分反应,能够说明氧化铜有剩余的实验现象是( )
①加入稀硫酸后,有气泡产生
②加入稀硫酸后,溶液显蓝色
③加入稀硫酸后,没有气泡产生
④加入稀硫酸后,容器中有红色不溶物质
⑤在加稀硫酸后的溶液中,插入铁片,铁片表面有红色不溶物质析出。
A. 只有① B. 只有② C. ③④ D. ②⑤
难度: 中等查看答案及解析
-
下列实验方案中错误的是
序号
实验目的
实验方案
A
除去KCl固体中的K2CO3
加入过量的稀盐酸,蒸发结晶
B
鉴别NH4Cl和KCl两种白色固体肥料
加入熟石灰研磨后闻气味
C
除去N2中的O2
缓缓通过灼热铜丝网
D
除去CO2中的HCl气体
通入足量NaOH溶液
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
继黄金、白金之后,钯金(Pd)首饰在市场上悄然兴起。为了获得钯金,取17.7%的PdCl2溶液100克,加入10.0克铁粉使其充分反应得到钯金和铁的氯化物(X),反应原理为aFe+bPdCl2=cPd+dx.经分析所得钯金的质量为10.6克,未反应的铁粉质量为4.4克。下列说法不正确的是( )
A. 参加反应的PdCl2质量为17.7克 B. 化学方程式中a和c的比为1:2
C. X为FeCl2 D. 生成X的质量为12.7
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 通常把pH<7的降水称为酸雨
B. 生活中常接触到的“高钙牛奶”、“碘盐”中的“钙”、“碘”指的是离子
C. 原子的质量几乎都集中在原子核中
D. 氯化铵可以与草木灰
含碳酸钾
混合施用
难度: 简单查看答案及解析
-
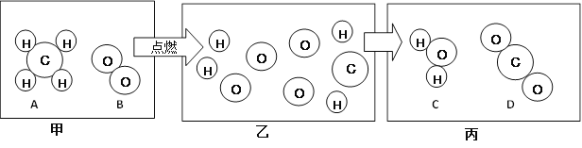
通过下列图示实验得出的结论中正确的是
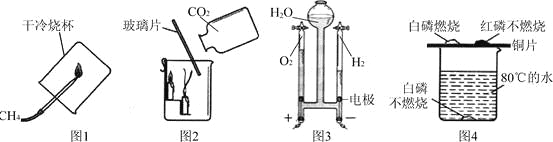
A. 图1所示实验既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素
B. 图2所示实验既说明二氧化碳密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧
C. 图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的
D. 图4所示实验既可探究可燃物的燃烧条件,又说明红磷不是可燃物
难度: 中等查看答案及解析
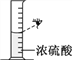 读取液体体积 B.
读取液体体积 B. 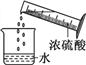 稀释浓硫酸
稀释浓硫酸 制取氢气 D.
制取氢气 D.  检验氢气纯度
检验氢气纯度