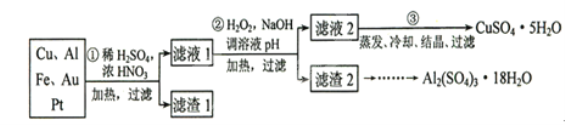
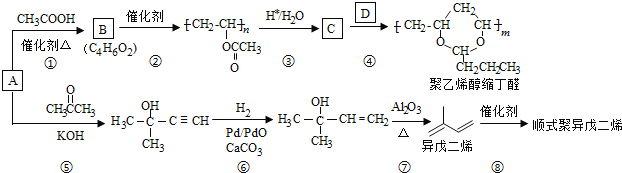
-
下列有关物质性质与用途具有对应关系的是
A. NaHCO3受热易分解,可用于制胃酸中和剂
B. SiO2熔点高硬度大,可用于制光导纤维
C. Al2O3是两性氧化物,可用作耐高温材料
D. CaO能与水反应,可用作食品干燥剂
难度: 中等查看答案及解析
-
纸是传承人类文明的载体之一,纸的主要化学成分是( )。
A. 纤维素 B. 蛋白质 C. 塑料 D. 淀粉
难度: 简单查看答案及解析
-
化学与人类社会的生活、生产密切相关。以下说法不正确的是( )。
A. 我国发射的“嫦娥三号”月球探测器中使用的碳纤维是一种新型无机非金属材料
B. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
C. “84消毒液”的有效成分NaClO具有强氧化性,能用来杀菌消毒
D. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
难度: 简单查看答案及解析
-
用化学用语表示 NH3+ HCl
NH4Cl中的相关微粒,其中正确的是( )
A. 中子数为8的氮原子:
B. HCl 的电子式:
C. NH3的结构式:
D. Cl−的结构示意图:
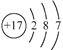
难度: 简单查看答案及解析
-
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
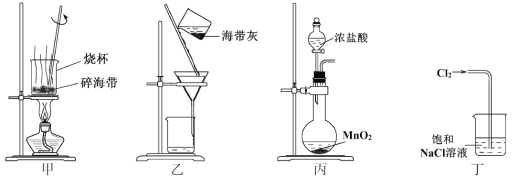
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B. 0.1mol丙烯酸中含有双键的数目为0.1NA
C. 标准状况下,11.2L苯中含有分子的数目为0.5NA
D. 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
B. (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C. 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D. 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
难度: 中等查看答案及解析
-
已知反应KClO3 + 6HCl= 3Cl2↑+KCl + 3H2O,下列有关的说法中,正确的是( )
A. HCl 中的Cl 全部被氧化 B. 失电子的氯原子是得电子的氯原子的5倍
C. 反应中有6mol电子发生转移 D. 反应中KClO3 被氧化
难度: 简单查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
难度: 简单查看答案及解析
-
如下图所示,反应2SO2(g)+O2(g)
2SO3(g);△H<0,在不同温度下、不同压强(p1>p2)下达到平衡,混合气体中SO3的体积分数φ(SO3)随温度变化的曲线应为
A.
 B.
B.  C.
C. 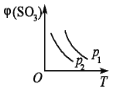 D.
D. 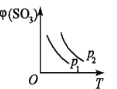
难度: 中等查看答案及解析
-
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述不正确的是
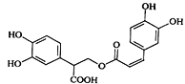
A. 迷迭香酸不属于芳香烃
B. 1mol迷迭香酸最多能和含6mol Br2的浓溴水反应
C. 迷迭香酸可以发生水解反应、取代反应和酯化反应
D. 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
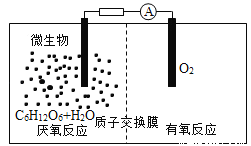
A. 正极反应中有CO2生成 B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区 D. 电池总反应为C6H12O6+6O2═6CO2+6H2O
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
室温下,下列溶液中粒子浓度关系正确的是( )
A. Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B. Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C. Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
难度: 困难查看答案及解析