-
下列有关物质性质与用途具有对应关系的是( )
A. Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B. ClO2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
难度: 中等查看答案及解析
-
CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是
A. 光合作用 B. 自然降雨 C. 化石燃料的燃烧 D. 碳酸盐的沉积
难度: 简单查看答案及解析
-
硅酸铜钡是利用最新科学技术才合成的一种物质,然而科学家惊奇发现,我国秦朝兵马俑的一种颜料竟是硅酸铜钡.由以上事实推测关于硅酸铜钡的说法不正确的是
A. 难氧化 B. 难溶于水 C. 属于硅酸盐 D. 属于混合物
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 含78个中子的碘原子:
B. 氮原子的结构示意图:
C. Na2S的电子式:
D. 乙醇的结构简式:C2H6O
难度: 简单查看答案及解析
-
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
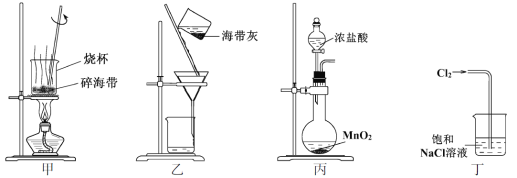
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
欲除去下列各物质中的少量杂质,括号内试剂选择正确的是
A. 溴苯中的溴(KI溶液) B. 溴乙烷中的乙醇(NaOH溶液)
C. 苯中的甲苯(溴水) D. 乙酸乙酯中的乙酸(饱和Na2CO3溶液)
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4
CaCO3+SO42−
B. 酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+=I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO42−+3Cl−+4H++H2O
D. 电解饱和食盐水:2Cl−+2H+
Cl2↑+ H2↑
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
B. 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA
C. NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA
D. 1 mol Fe在氧气中充分燃烧失去3NA个电子
难度: 中等查看答案及解析
-
H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.
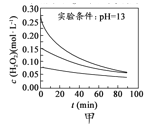 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快B.
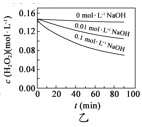 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快C.
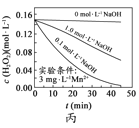 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快D.

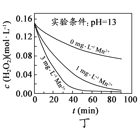 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大难度: 中等查看答案及解析
-
萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
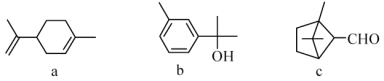
A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 反应 NH3(g) +HCl(g)
NH4Cl(s)的 △H<0,△S<0
B. 若在海轮外壳上附着一些钢块,则可以减缓海轮外壳的腐蚀
C. 用pH均为11的氨水和氢氧化钠溶液分别中和等体积、等浓度的盐酸,消耗氨水的体积大
D. H2O与Na2O2反应生成1 mol O2,反应中转移的电子数为4×6. 02×1023
难度: 中等查看答案及解析
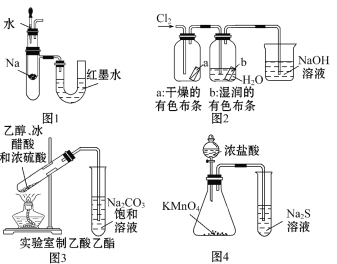

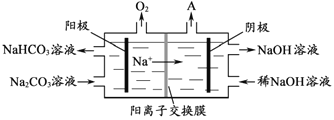
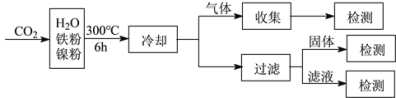
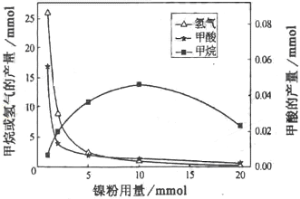
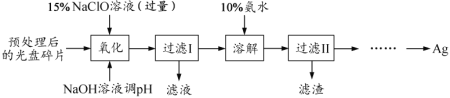
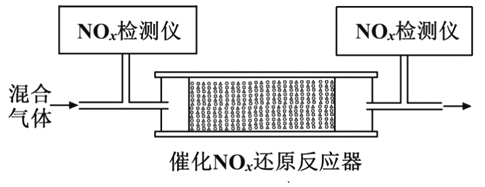
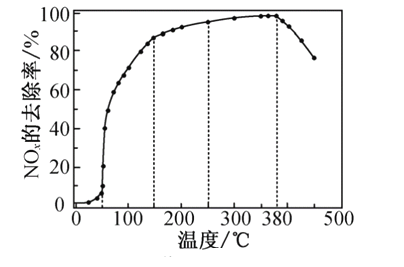 。
。