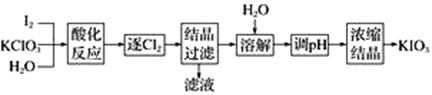
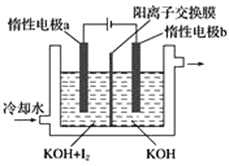
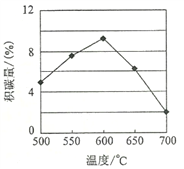
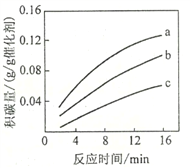
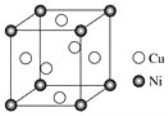
-
下列叙述不正确的是
A. 淀粉、油脂、蛋白质都能水解,且水解产物各不相同
B. 石油催化裂化的主要目的是提高芳香烃的产量
C. 从煤的干馏产物中可以获得焦炉气、粗氨水、煤焦油、焦炭等重要的化工原料
D. 误服重金属盐,立即服用牛奶或豆浆可解毒
难度: 简单查看答案及解析
-
下列实验与物质微粒大小无直接关系的是 ( )
A. 过滤
 B. 渗析
B. 渗析C. 萃取
 D. 丁达尔效应
D. 丁达尔效应难度: 中等查看答案及解析
-
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
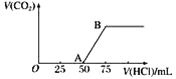
A. OA段所发生反应的离子方程式:H++OH-===H2O
B. NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1
C. 产生的CO2体积(标准状况下)为0.056 L
D. 稀释液中NaOH的物质的量浓度为0.025 mol·L-1
难度: 中等查看答案及解析
-
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O===SO42-+2Fe2++4H+;②Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
下列有关说法不正确的是( )
A. SO2发生氧化反应
B. 氧化性:Cr2O72->Fe3+> SO42-
C. 每1 mol K2Cr2O7参加反应,转移电子的数目为6NA
D. 若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 mol/L NaAlO2溶液中:H+、Na+、Cl-、SO32﹣
B. 无色溶液中:K+、Ca2+、Cl-、NO3-
C. 使酚酞变红色的溶液中:Na+、Cu2+、HCO3-、NO3-
D. 使石蕊变红的溶液中:H+、Na+、Fe2+、MnO4-
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4
CaCO3+SO42−
B. 酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+=I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO42−+3Cl−+4H++H2O
D. 电解饱和食盐水:2Cl−+2H+
Cl2↑+ H2↑
难度: 中等查看答案及解析
-
将Na2O2投入FeCl3溶液中,可观察到的现象是 ( )
①生成白色沉淀 ②生成红褐色沉淀 ③有气泡产生
④因为Na2O2具有漂白性,所以FeCl3溶液褪色
A. ①④ B. ②③ C. ①③ D. 仅②
难度: 中等查看答案及解析