-
化学与生活密切相关。下列说法错误的是
A. 用白磷作包装食品的脱氧剂 B. 食品保鲜膜能减缓食品中水分的蒸发
C. 用液氨作制冷剂冷藏物品 D. 用臭氧对医疗器械进行消毒
难度: 简单查看答案及解析
-
臭氧已成为夏季空气污染的元凶,地表产生氧的机理如图所示。下列说法正确的是
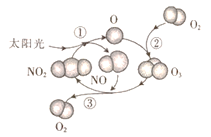
A. NO是反应③的催化剂
B. O3、O是反应的中间体
C. 反应①②③均是氧化还原反应
D. 产生臭氧的化学方程式为3O2
2O3
难度: 简单查看答案及解析
-
下列说法错误的是
A. 液态二氧化碳灭火剂可扑灭一般的起火,也适用于金属起火
B. 常用高温和紫外线对医疗器械进行消毒,是因为高温和紫外线可使蛋白质变性
C. 影化食品中禁止使用含铝的食品添加剂,是因为铝元素会危害人体健康
D. 家庭装修时用植物生态涂料代替传统墙面涂料,有利于健康及环境
难度: 中等查看答案及解析
-
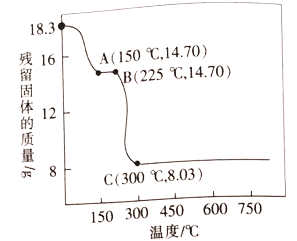
形成酸雨的过程如图所示。下列说法正确的是

A. 含NOx、SO2的烟气和酸雨的分散剂相同
B. 酸周沉降到地面后酸性还会有所增强
C. 机动车尾气中的NOx来源于燃油中的含物质
D. 在已酸化的土壤中加消石灰可以减少酸雨的形成
难度: 简单查看答案及解析
-
实验室欲从含MgBr2的水中提取Br2,下列操作未涉及的是
A. 氧化
 B. 过滤
B. 过滤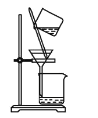 C. 分液
C. 分液 D. 蒸馏
D. 蒸馏
难度: 简单查看答案及解析
-
下列有关物质性质与应用对应关系错误的是
选项
化学性质
实际应用
A
ClO2具有强氧化性
用于自来水的消毒杀菌
B
Na2O2与CO2和H2O均能发生反应
用作呼吸面具供氧剂
C
钠的金属性比钾弱
Na与KCl反应制取单质钾
D
FeCl3溶液能与Cu反应
用FeCl3溶液蚀刻印刷电路板
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.1 mol NH4 F中含有的质子数为2NA
B. 1LpH=12的Na2CO3溶液中含Na+的数目为0.01NA
C. 2.24L(标准状况)Cl2溶于水,生成H+的数目为0.1NA
D. 含6.08乙酸的水溶液中氧原子的数目为0.2NA
难度: 简单查看答案及解析
-
下列实验操作不当的是
A. 进行焰色反应时,用铜丝蘸取某碱金属盐溶液灼烧,观察火焰颜色
B. 用标准盐酸来滴定氨水测定其浓度时,应选择甲基橙作指示剂
C. 蒸发结晶过程中不断用玻璃棒搅拌液体至大部分晶体析出时停止加热
D. 测定溶液pH时,用洁净的玻璃棒蘸取待测液滴在干燥pH试纸上,然后比色
难度: 简单查看答案及解析
-
下列物质的转化在给定条件下均能通过一步反应实现的是
A. NaAlO2(aq)
 AlCl3
AlCl3 Al2O3 B. NaCl(饱和)
Al2O3 B. NaCl(饱和) NaHCO3
NaHCO3Na2CO3 C. N2
 NO2
NO2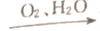 HNO3
HNO3D. FeS2
 SO3
SO3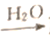 H2SO4
H2SO4难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 向NaHCO3溶液中加入NaOH溶液:HCO3—+OH—=CO2↑+H2O
B. 4mol・L—1的 NaAlO2溶液和7mol・L—1的盐酸等体积混合:4AlO2—+7H++H2O=3A1(OH)3↓ +Al3+
C. 酸性条件下,用H2O2将I—转化为I2:H2O2+2I-=I2+2OH—
D. 向Ca(ClO)2溶液中通入过量CO2:2ClO-+CO2+H2O=2HClO+CO32—
难度: 困难查看答案及解析
-
实验室用HCl和O2制备氯气并检验氯气性质的装置如图所示。下列说法正确的是
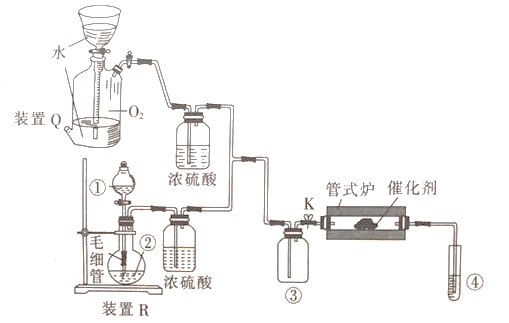
A. ①、②中盛放的试剂依次为浓盐酸、浓硫酸
B. 管式炉中发生反应时,氧化剂与还原剂的物质的量之比为1:2
C. 实验结東时先停止加热,关闭K,再从④中拿出导管
D. 装置Q(贮气瓶)可用于贮存NH3
难度: 中等查看答案及解析
-
下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.2mol·L-1的硫酸
量取5mL10.0mol/L硫酸,转移至250mL的容量瓶中定容
B
探究亚硫酸钠的还原性
向盛有2mL亚硫酸钠溶液的试管中滴加浓盐酸,观察颜色变化
C
制取并纯化氯气
向二氧化锰中加入浓盐酸并加热,将产生的气体依次通过饱和碳酸氢钠溶液和浓硫酸
D
探究催化剂对反应速率的影响
向试管中同时加入2mL5%H2O2溶液,向其中一个试管中滴入1滴氯化铁溶液,观察实验现象
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某白色粉末由两种物质组成,为鉴定其成分进行如下实验:①取少量样品加入足量水中,有气泡产生且仍有部分固体未溶解,再继续加入足量稀硝酸,固体全部溶解;②取少量样品加入足量稀硫酸,有气泡产生,振荡后仍有固体存在。该白色粉末可能为
A. Ba(HCO3)2、AlCl3 B. Mg(OH)2、 NH4HCO3
C. NaHSO4、BaCO3 D. NaHCO3、KAl(SO4)2・12H2O
难度: 困难查看答案及解析
-
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。在回收过程中涉及如下化学反应SeO2+
4KI+4HNO3=Se+2I2+4KNO3+2H2O②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O
③Se+4HNO3(浓)=SeO2+4NO2↑+2H2O.下列有关叙述正确的是
A. 反应①中Se是氧化产物,I2是还原产物
B. 反应①中生成0.6mol1,转移的电子数目为2.4NA
C. 反应②、③中等量的Se消耗浓H2SO4和浓HNO3的物质的量之比为2:1
D. SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
难度: 中等查看答案及解析
-
银锌电池在商业、宇航潜艇、核武器等领域有广泛应用。一种从正极片(含Ag、Ag2O、石墨及Cu等)中回收银的流程如下,下列叙述错误的是

A. 滤液a中含有Na+、Cu2+、H+等阳离子
B. A用氨水溶解时发生的反应为AgCl+2NH3・H2O=[Ag(NH3)2]++C1-+2H2O
C. 滤液c可浓缩结晶得到Zn(NO3)2
D. 向滤渣d中加稀硫酸可溶解其中过量的Zn
难度: 中等查看答案及解析
-
某溶液中含有等物质的量的K+、Na+、Fe3+、Fe2+、SO42—、SO32—、I—、NO3—中的几种离子,为确定其组成,取三份该溶液进行了如下实验(不考虑盐类的水解及水的电离,I—能被酸性高锰酸钾溶液氧化为IO3—)
(1)第一份:滴入酸性高锰酸钾溶液,溶液紫红色褪去
(2)第二份:加入过量稀盐酸,始终没有气泡逸出
(3)第三份:加入氯化钡溶液,产生白色沉淀
下列说法不正确的是
A. 溶液中不可能含有NO3— B. 溶液中不可能含有Fe2+
C. 溶液中不可能含有Fe3+ D. 溶液中不可能含有SO32—
难度: 中等查看答案及解析