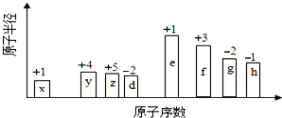
-
下列由实验得出的结论正确的是( )
实验
结论
A.
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2-二溴乙烷无色、可溶于四氯化碳
B.
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C.
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
D.
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的氯甲烷具有酸性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是
A. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
B. 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
C. 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应
D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
难度: 简单查看答案及解析
-
下列有关物质性质的比较,结论正确的是
A. 溶解度:Na2CO3>NaHCO3 B. 热稳定性:HCl<PH3
C. 沸点:H2O<H2S D. 碱性:LiOH<Be(OH)2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. CaCl2中既有离子键又有共价键,所以属于离子化合物
B. H2O汽化成水蒸气、分解为H2和O2,都需要破坏共价键
C. C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点不同
D. CH3COOH和CH3COOCH3互为同系物
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 油脂皂化反应可用硫酸作催化剂
B. 油脂和蛋白质都能发生水解反应
C. 淀粉溶液中加入硫酸,加热4~5min,再加入少量银氨溶液,加热,有光亮银镜生成
D. 花生油的主要成分是高级脂肪酸甘油酯,属于高分子化合物
难度: 中等查看答案及解析
-
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.
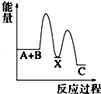 B.
B. 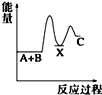
C.
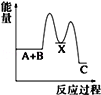 D.
D. 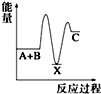
难度: 中等查看答案及解析
-
一定温度下,浓度均为1mol/L的A2和B2两种气体,在密闭容器内反应生成气体C,达平衡后,测得:c(A2)=0.58mol/L,c(B2)=0.16mol/L,c(C)=0.84mol/L,则该反应的正确表达式为
A. 2A2+B2
2A2B B. A2+2B2
2AB2
C. A2+B2
A2B2 D. A2+B2
2AB
难度: 中等查看答案及解析
-
利用如图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法中正确的是
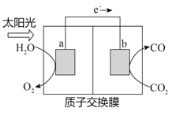
A. 电极a表面发生还原反应
B. 该装置工作时,H+从b极区向a极区移动
C. 该装置中每生成2 mol CO,同时生成1 mol O2
D. 反应过程中,电极a附近溶液的pH值将增大
难度: 中等查看答案及解析
-
苯乙烯(
)是重要的化工原料。下列有关苯乙烯的说法错误的是
A. 与溴水混合后加入铁粉可发生取代反应 B. 能使酸性高锰酸钾溶液褪色
C. 所有原子可能在同一平面 D. 在催化剂存在下可以制得聚苯乙烯
难度: 中等查看答案及解析
-
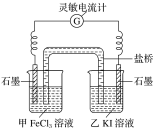
下图甲和乙是双液原电池装置。由图可判断下列说法错误的是( )
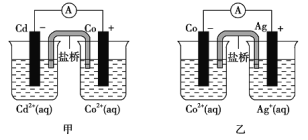
A. 乙图电池反应的离子方程式为:Co(s)+2Ag+(aq)=2Ag(s)+Co2+(aq)
B. 反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq) 不能发生
C. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D. 甲图当有1mol电子通过外电路时,正极有59g Co析出
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. S(s)+3/2O2(g)=SO3 (g) △H=-315kJ·mol-1(燃烧热)(△H的数值正确)
B. 氢气的燃烧热为285.5kJ•mol-1,则2H2O(l)=2H2(g)+O2(g) △H=+285.5kJ•mol-1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)
2NH3(g) △H=-92.4kJ•mol-1;将3 mol H2和过量的N2在此条件下充分反应,放出的热量小于92.4kJ
D. 已知HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(aq) △H=-57.3 kJ·mol-1
难度: 中等查看答案及解析
-
恒温恒容条件下,反应A(g)+B(g)
C(g)+D(s) △H>0,一定能使其逆反应速率加快的是
A. 减少A或B的物质的量 B. 充入氦气使压强增大
C. 升高温度 D. 增大D的物质的量
难度: 中等查看答案及解析
-
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法错误的是( )
A. 改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液反应,求得中和热数值和原来相同
B. 用50mL 0.50mol/L盐酸和50mL 0.55mol/L NaOH溶液进行实验比用50mL0.50mol/L盐酸和50mL 0.50mol/L NaOH测得的数值准确
C. 酸碱混合时,量筒中NaOH溶液应慢慢倒入小烧杯中,再用环形玻璃搅拌棒搅拌
D. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
难度: 简单查看答案及解析
-
把5mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s)
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol•L-1•min-1,下列结论错误的是( )
A. B的平均反应速率为0.1mol•L-1•min-1 B. 平衡时,容器内压强为原来的0.9倍
C. 平衡时,C的浓度为0.25mol•L-1 D. A的平均反应速率为0.15mol•L-1•min-1
难度: 中等查看答案及解析
-
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
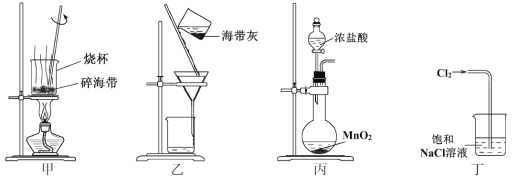
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
已知:a.C2H2(g)+H2(g)=C2H4(g) △H<0; b.2CH4(g)=C2H4(g)+2H2(g) △H>0
判断以下三个热化学方程式中△H1、△H2、△H3的大小顺序是( )
①C(s)+2H2(g)=CH4(g) △H1 ②C(s)+H2(g)=1/2C2H4(g) △H2
③C(s)+1/2H2(g)=1/2C2H2(g) △H3
A. △H2>△H3>△H1 B. △H3>△H2>△H1
C. △H3>△H1>△H2 D. △H1>△H2>△H3
难度: 中等查看答案及解析
-
已知反应:2NO(g)+Br2(g)
2NOBr(g) △H=-a kJ·mol-1(a>0),其反应机理是
① NO(g)+Br2 (g)
NOBr2 (g) 快 ② NOBr2(g)+NO(g)
2NOBr(g) 慢
下列有关该反应的说法正确的是
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 增大Br2 (g)的浓度能增大活化分子百分数,加快反应速率
D. 总反应中生成物的总键能比反应物的总键能大a kJ·mol-1
难度: 中等查看答案及解析
-
氮化硅陶瓷能代替金属制造发动机的耐热部件。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)
Si3N4(s)+12HCl(g) △H<0。若在恒压绝热容器中反应,下列选项表明反应一定已达化学平衡状态的是( )
A. 容器的温度保持不变 B. 容器的压强保持不变
C. υ正(N2)=6υ逆(HCl) D. 容器内的气体c(N2)∶c(H2)∶c(HCl)=1∶3∶6
难度: 困难查看答案及解析
-
用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
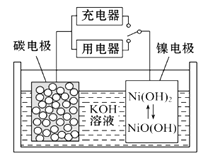
A. 放电时,负极的电极反应为:H2-2e-=2H+
B. 充电时,阳极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O
C. 充电时,将电池的碳电极与外电源的正极相连
D. 放电时,OH-向镍电极作定向移动
难度: 中等查看答案及解析
-
某化学反应中,反应混合物A、B、C的物质的量浓度(c )与时间(t)关系如下所表示
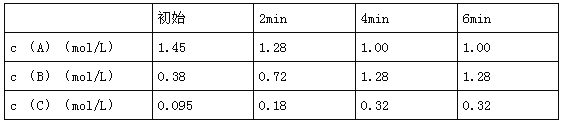
下列说法错误的是( )
A. 该反应的化学方程式为2A
4B+C B. 逆反应是放热反应
C. 4min时A的转化率约为31% D. 4~6min时,反应处于动态平衡
难度: 困难查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
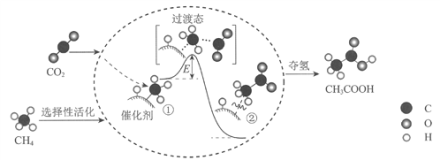
下列说法不正确的是( )
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②吸收能量并形成了C―C键
D. 该催化剂选择性活化了甲烷分子
难度: 中等查看答案及解析