-
在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列实验仪器不宜直接用来加热的是( )
A. 试管 B. 坩埚 C. 蒸发皿 D. 烧杯
难度: 简单查看答案及解析
-
容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
A. ②④⑥ B. ③⑤⑥ C. ①②④ D. ①③⑤
难度: 简单查看答案及解析
-
下列说法不正确的是
①不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用水来灭火;②不慎将浓硫酸溶液沾到皮肤上,应立即用3%-5%的小苏打溶液清洗;③用托盘天平称量物质质量时,物品应置于右盘;④实验时应节约药品,所有实验剩余的药品应放回原试剂瓶;⑤可燃性气体点燃前一定要验纯; ⑥给试管里的固体加热时,试管口应向下倾斜45°;⑦配制一定浓度的NaCl溶液时,定容振荡摇匀后,发现液面低于刻度线,再加水至刻度线;
A. ②④⑤⑥⑦ B. ①③④⑥⑦ C. ②③⑥⑦ D. ①③④⑤⑥
难度: 简单查看答案及解析
-
利用下列实验装置完成相应的实验,能达到实验目的的是( )
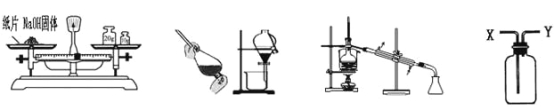
A. 称量NaOH固体 B. 用酒精提取溴水中的溴 C. 除去水中的氯化钠 D. 从Y进气收集CO2
难度: 中等查看答案及解析
-
从下列混合物中分离出其中的一种成分,所采取的分离方法正确的是
A. 由于碘在酒精中的溶解度大,可以用酒精把碘水中的碘萃取出来
B. 水的沸点为100 ℃,酒精的沸点为78.5 ℃,所以用加热蒸馏的方法使含水的酒精变为无水酒精
C. 由于沙子和水不相溶,且存在明显的密度差异,因此可用过滤法分离沙子与水的混合物
D. 可以用冷却法从热的含少量的KNO3的NaCl浓溶液中分离得到纯净的NaCl
难度: 简单查看答案及解析
-
某实验室仅有如下仪器或用具:烧杯、铁架台、铁圈、三脚架、漏斗、分液漏斗、石棉网、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴、锥形瓶。从缺少仪器的角度来看,不能进行的实验操作是
A. 蒸发 B. 萃取 C. 过滤 D. 蒸馏
难度: 简单查看答案及解析
-
下列实验过程中出现的异常情况,其可能原因分析错误的是
选项
异常情况
可能原因分析
A
蒸发结晶:蒸发皿破裂
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部
B
分液:分液漏斗中的液体难以滴下
没有打开分液漏斗活塞
C
萃取:液体静置不分层
加入萃取剂的量较多
D
蒸馏:冷凝管破裂
冷凝管没有通水或先加热后通水
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列对实验过程的评价正确的是
A. 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性
B. 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42-
C. 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3
D. 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl-
难度: 中等查看答案及解析
-
有甲、乙、丙三种溶液,进行如下操作,则甲、乙、丙三种溶液可能是
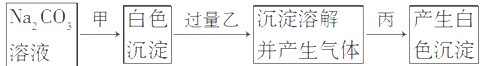
A. BaCl2、H2SO4、MgCl2 B. BaCl2、HCl、Na2SO4 C. CaCl2、HNO3、NaCl D. CaCl2、H2SO4、AgNO3
难度: 中等查看答案及解析
-
某溶液中含有较大量的Cl-、CO32-、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A. ①②④②③ B. ④②①②③ C. ①②③②④ D. ④②③②①
难度: 中等查看答案及解析
-
下列关于“摩尔”的说法正确的是( )
A. 摩尔是一个物理量 B. 摩尔是表示物质的量
C. 摩尔是物质的量的单位 D. 摩尔是表示物质数量的单位
难度: 简单查看答案及解析
-
ag H2O中含有b个氢原子,则阿伏加德罗常数为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列有关摩尔质量的描述或应用中,正确的是
A. 1 mol OH-的质量为17 g B. 二氧化碳的摩尔质量为44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 摩尔质量是表示物质的质量的单位
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 若1 mol氢气体积为22.4 L,则一定是标准状况
B. 在标准状况下,1 mol水的体积为22.4 L
C. 1 mol O2的质量只有在标准状况下才是32 g
D. 0 ℃、101 kPa下,1 mol空气的体积约为22.4 L
难度: 中等查看答案及解析
-
标准状况下,测得1.92g 某气体的体积是672mL,则该气体的摩尔质量是( )
A. 64g/mol B. 64g C. 32g D. 32g/mol
难度: 简单查看答案及解析
-
决定气体的体积的主要因素有( )
①气体的分子个数 ②气体分子的大小 ③气体分子间的平均距离 ④气体分子的相对分子质量
A. ①② B. ①③ C. ②③ D. ②④
难度: 简单查看答案及解析
-
在标准状况下①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,下列对这四种气体的关系从大到小表达正确的是( )
a.体积②>③>①>④ b.密度②>③>④>① c.质量②>③>①>④ d.氢原子个数①>③>④>②
A. abc B. bcd C. abcd D. acd
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 阿伏伽德罗常数是6.02×1023 B. 标准状况下,11.2 L CCl4所含分子数为0.5NA
C. 0.1 mol CH4所含氢原子数为0.4NA D. 常温常压下,28 g N2中所含原子个数为NA
难度: 简单查看答案及解析
-
在同温同压下,A容器中的氧气(O2)和B容器中的氨气(NH3)所含的原子个数相同,则A、B两容器中气体的体积之比是
A. 1∶2 B. 2∶1 C. 2∶3 D. 3∶2
难度: 简单查看答案及解析
-
下列各组物质中所含氧原子的物质的量相同的是
A. 0.3 mol O2和0.3mol H2O B. 6.02×1023个CO2与0.1 mol KMnO4
C. 0.1mol CuSO4·5H2O与0.1 mol C6H12O6 D. 0.2mol SO3与0.3mol SO2
难度: 简单查看答案及解析
-
下列实验操作正确的是
A. 使用容量瓶配制溶液,移液时应洗涤烧杯2~3次 B. 用100 mL量筒量取5.5 mL稀盐酸
C. 用托盘天平称量11.50 g NaCl固体 D. 配制一定浓度的溶液时,固体物质可以直接在容量瓶中溶解
难度: 简单查看答案及解析
-
下列溶液中Cl-物质的量浓度最大的是
A. 100mL 0.25 mol/L的HCl溶液10mL B. 20mL 0.1 mol/L的MgCl2溶液
C. 30mL 0.2 mol/L的KCl溶液 D. 0.1 mol/L的FeCl3溶液
难度: 中等查看答案及解析
-
同为1L的HCl溶液(浓度为c1)和H2SO4溶液(浓度为c2),若其中的c(H+)相同,则它们的物质的量的浓度c1和c2的关系是
A. c1 < c2 B. 2c1=c2 C. c1=2c2 D. 不能确定
难度: 中等查看答案及解析
-
某校化学兴趣小组在实验中发现一瓶溶液,标签上标有“CaCl2 0.1 mol·L−1”的字样,下面是该小组成员对溶液的叙述,正确的是
A. 配制1L溶液,可将0.1mol的CaCl2溶于1L水 B. 该溶液稀释一倍,所得溶液c(Cl−)=0.1mol·L−1
C. Ca2+和Cl−的浓度都是0.1 mol·L−1 D. 取该溶液的一半,则所取溶液c=0.05 mol·L−1
难度: 中等查看答案及解析