-
下列物质分类正确的是
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、四氯化碳均为电解质
D. 福尔马林、水玻璃、氨水均为混合物
难度: 简单查看答案及解析
-
下列说法不正确的是
①将BaSO4放入水中不能导电,所以BaSO4是非电解质 ②氨溶于水得到的氨水能导电,所以氨水是电解质 ③固态共价化合物不导电,熔融态的共价化合物可以导电 ④固态的离子化合物不导电,熔融态的离子化合物也不导电 ⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A. ①④ B. ①④⑤ C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
常温下下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B. 由水电离出的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、Cl-、HCO3-、K-
C. c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
难度: 简单查看答案及解析
-
化学与生产、生活密切相关,下列说法正确的是
A. 用过滤法无法除去Fe(OH)3胶体中的FeCl3
B. 将适量的铜、锌熔合成合金的过程发生了化学变化
C. 明矾净水时发生了化学变化及物理变化,能起到杀菌消毒的作用
D. 硝酸型酸雨与氧化还原反应无关
难度: 简单查看答案及解析
-
下列有关金属及其合金的说法不正确的是 ( )
A. 目前我国流通的硬币是由合金材料制造的 B. 生铁、普通钢和不锈钢中的碳含量依次增加 C. 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 D. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
难度: 中等查看答案及解析
-
(4分)(2012•广东)下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂
B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮
D. 实验室用NH4Cl和Ca(OH)2制备NH3
难度: 中等查看答案及解析
-
根据所给的信息和标志,判断下列说法错误的是( )
A
B
C
D
《神农本草经》记载,麻黄能“止咳逆上气”
碳酸氢钠药片


古代中国人已用麻黄治疗咳嗽
该药是抗酸药,服用时喝些醋能提高药效
看到有该标志的丢弃物,应远离并报警
贴有该标志的物品是可回收物
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列叙述不正确的是
A. 氧化镁的熔点高,可用作耐高温材料
B. 用烧碱处理含高浓度NH4+的废水并回收利用氨
C. 有机物均不导电
D. 氯化铁溶液能腐蚀铜,可用于制作印刷电路板
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. 用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+
H2↑ + Cl2↑
B. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3+ + 4NH3·H2O ═ AlO2-+ 4NH4+ + 2H2O
C. 苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O-→ 2C6H5OH + 2 CO32-
D. Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- ═ 5SO42-+ 2Mn2+ + 3H2O
难度: 简单查看答案及解析
-
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是
A. S2Cl2中S的化合价为-2 B. H2O作还原剂
C. 每生成1 mol SO2转移3 mol电子 D. 氧化产物与还原产物物质的量比为3∶1
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 16 g O2和O3的混合气体中含有的分子数为0.5NA
B. 0.3 mol AgNO3受热完全分解(2AgNO3===2Ag+2NO2↑+O2↑),用排水法收集到气体的分子数为 0.25NA
C. 100 mL 12 mol·L-1浓盐酸与足量MnO2共热,生成的Cl2分子数为0.3NA
D. 2.3 g金属钠在装有氧气的集气瓶中完全燃烧,转移的电子数为0.1NA
难度: 中等查看答案及解析
-
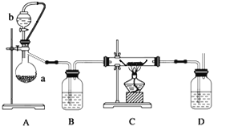
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是

A. 该硫酸的物质的量浓度为 9.2 mol/L
B. 1 mol Zn与足量的该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
难度: 简单查看答案及解析
-
下列配制溶液的叙述中错误的是
A. 配制FeSO4溶液制备Fe(OH)2,需要把蒸馏水煮沸除去氧气后,再溶解配制FeSO4溶液
B. 配制480 mL 0.1 mol·L-1的CuSO4溶液,需称量8 g CuSO4固体
C. 配制FeCl3溶液时,先把FeCl3固体溶于浓盐酸然后再加水稀释
D. 配制1 mol·L-1NaOH溶液时,称量4.0 g NaOH固体置于100 mL容量瓶中,加水溶解并稀释到刻度线
难度: 简单查看答案及解析
-
将一定量的CO2气体通入2LNaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl物质的量关系如图所示,下列说法不正确的是
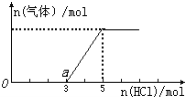
A. O点溶液中所含溶质的化学式为NaOH、Na2CO3
B. a点溶液中c (HCO3-)>c (CO32-)
C. 标准状况下,通入CO2的体积为44.8L
D. 原NaOH溶液的物质的量浓度为5mol/L
难度: 中等查看答案及解析
-
有BaCl2和NaCl的混合溶液0.5 L,将它均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀,反应中消耗1.5 mol H2SO4、3.8 mol AgNO3。据此得知原混合溶液中的c(Na+)为
A. 1.6 mol·L-1 B. 3.2 mol·L-1 C. 4.8 mol·L-1 D. 9.6 mol·L-1
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 向20 mL 0.5 mol·L-1 FeBr2溶液中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
B. 向30 mL 0.5 mol·L-1 NaOH溶液中通入224 mL CO2(标准状况):3OH-+2CO2===CO32-+HCO3-+H2O
C. 含2 mol NaOH的溶液和含1 mol Ca(HCO3)2的溶液混合:OH-+Ca2++HCO3-===CaCO3↓+H2O
D. 含0.03 mol NaHCO3的溶液和0.02 mol Ca(OH)2的溶液混合:3HCO3-+Ca2++ 3OH-===2CO32-+CaCO3↓+3H2O
难度: 困难查看答案及解析
-
已知反应:①Cl2+2KI═2KCl+I2②KClO3+6HCl═3Cl2↑+KCl+3H2O③2KIO3+Cl2═I2+2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为KIO3>KClO3>Cl2>I2
C. 反应②中还原剂与氧化剂的物质的量之比为6∶1
D. ③中1 mol还原剂反应则氧化剂得到电子的物质的量为2 mol
难度: 简单查看答案及解析
-
用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
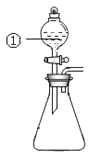
选项
①中物质
②中物质
预测②中的现象
A.
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B.
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C.
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D.
草酸溶液
高锰酸钾酸性溶液
溶液逐渐褪色
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
和溶液,又有CaCO3沉淀生成
B. 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D. 向Na2 CO3饱和溶液中通入CO2,有NaHCO3结晶析出
难度: 中等查看答案及解析
-
根据如图的转化关系判断下列说法正确的是(反应条件已略去)
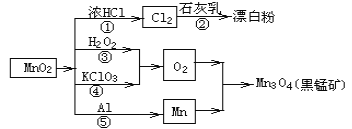
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
难度: 困难查看答案及解析
-
下列物质转化在给定条件下能实现的是
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq
无水FeCl3
⑤MgCl2
Mg(OH)2
MgO
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①②④⑤
难度: 中等查看答案及解析
-
某溶液A 可能含有Na+、Fe3+、Ba2+、NH4+、Cl-、SO42-、HCO3-、HSO3-中的几种离子,溶液中阳离子浓度相同。为了确定其组成,进行如下实验(假设气体全部逸出,忽略H2O2分解)

下列说法不正确的是( )
A. 溶液A 中一定不存在Fe3+、SO42-
B. 溶液A中肯定存在HCO3-、HSO3-、Ba2+、NH4+
C. 溶液A 中一定存在Cl-,且n(Cl-)=0.01mol
D. 溶液A中可能存在Na+,为了确定是否存在,可取溶液通过焰色反应验证
难度: 困难查看答案及解析
-
下列有关混合物分离方法和原理分析都正确的是( )
选项
操作方法
实验原理
A
铁粉中混有少量铝粉:溶于浓氢氧化钠溶液,过滤
铝粉与氢氧化钠溶液反应,铁粉不和氢氧化钠溶液反应
B
氯化亚铁溶液中混有氯化铁:加入足量铜粉,过滤
铜能将Fe3+还原成Fe2+,铜与Fe2+不反应
C
过氧化钠中混有氧化钠:在空气中灼烧固体
氧化钠与氧气在加热条件下生成过氧化钠
D
氯化铝溶液中混有氯化镁:加入足量氢氧化铝,过滤
氯化镁水解生成盐酸,盐酸与氢氧化铝反应,促进Mg2+完全水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
甲、乙、丙、丁、戊是中学化学中常见的无机物,其中甲、乙为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是
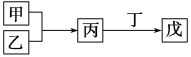
A. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
B. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙为Na2O2
C. 若丙、丁混合产生白烟,且丙分子为18电子分子,丁分子为10电子分子,则乙的水溶液可能具有漂白作用
D. 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
难度: 中等查看答案及解析