-
下列做法科学的是
A. 将废旧电池深埋处理 B. 大量开发利用可燃冰
C. 开发太阳能、风能和氢能 D. 大量砍伐树木、野草作燃料
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A. 氯化铵的电子式:
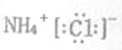 B. 中子数为18的硫原子:
B. 中子数为18的硫原子: S
C. 水分子的球棍模型:
 D. 乙烯的结构简式:CH2=CH2
D. 乙烯的结构简式:CH2=CH2难度: 中等查看答案及解析
-
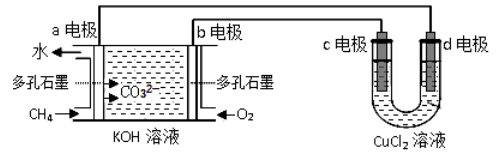
下列设备工作时,将化学能转化为电能的是( )

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关甲烷的说法正确的是
A. 易溶于水 B. 是最简单的有机化合物
C. 与氯气发生加成反应 D. 与乙烷互为同分异构体
难度: 中等查看答案及解析
-
下列各组物质互为同素异形体的是
A. H、D和T B. 甲烷与丙烷
C. 乙醇与二甲醚 D. 红磷与白磷
难度: 中等查看答案及解析
-
下列变化过程中,只破坏共价键的是
A. 干冰和I2的升华 B. NaCl颗粒被粉碎
C. SiO2晶体受热熔化 D. 从NH4HCO3中闻到了刺激性气味
难度: 中等查看答案及解析
-
下列排列顺序不正确的是
A. 原子半径:Na>Si>O B. 单质的沸点:I2>Br2>Cl2
C. 碱性:CsOH>KOH>NaOH D. 失电子能力: Al>Mg>Na
难度: 困难查看答案及解析
-
X、Y、Z、W是四种金属单质.把X浸入Z的硝酸盐溶液中,X的表面有Z析出:X、Y和稀硫酸组成原电池时,X电极上有气泡生成,Z、W相连接后放入稀硫酸中,电子由Z流向W。X、Y、Z三种金属的活动性顺序为
A. Y>X>Z>W B. W>X>Z>Y C. X>Y>Z>W D. Y>Z>X>W
难度: 中等查看答案及解析
-
用锌片与1mol·L-1稀盐酸反应制取氢气,下列措施不能使反应速率增大的是
A. 改用锌粉 B. 滴入几滴硫酸铜溶液
C. 加入少量1mol·L-1稀硫酸 D. 加入少量NaCl溶液
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 短周期元素是指1~20号元素 B. 核素的种类和元素的种类一样多
C. 元素周期表中共有18列、16个族 D. 主族元素的最高正阶均等于其族序数
难度: 中等查看答案及解析
-
下列说法正确的是
A. 乙烷、乙烯、乙炔均可使酸性高锰钾溶液褪色
B. 石油的分馏是物理变化,得到的各个馏分都是纯净物
C. 甲烷和氯气光照时的反应产物常温时均呈气态,且均难溶于水
D. 石油裂化的主要目的是提高汽油等轻质油的产量和质量
难度: 中等查看答案及解析
-
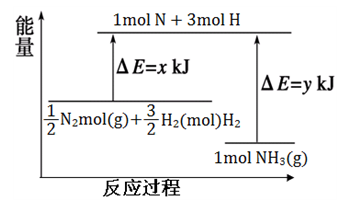
根据下图提供的信息,下列所得结论正确的是

A. 该反应的△H<0
B. 生成物比反应物稳定
C. 该图可以表示石灰石高温分解反应
D. 生成物的总键能高于反应物的总键能
难度: 中等查看答案及解析
-
阿伏加德罗常数值约为6.02×1023。下列有关叙述正确的是
A. 1molNH4Cl固体中共价键总数为5×6.02×1023
B. 14 g乙烯和丙烯混合气体中的氢原子数约为2×6.02×1023
C. 1molN2与4molH2充分反应,生成的NH3分子数约为2×6.02×1023
D. 铜 锌(稀硫酸)原电池,毎转移2×6.02×1023个电子正极消耗1mol铜
难度: 中等查看答案及解析
-
下图中表示碳原子相互结合的几种方式。小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合,则下列说法正确的是

A. 图中属于烷烃的是A、C、D
B. 图中C和E分子中氢原子数相同
C. 图中物质碳元素的质量分数最小的是A
D. 图中与B互为同分异构体的有C、D、E
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是
A. 化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率
B. 对于可逆反应来说,升高温度,正反应速率与逆反应速率均会增大
C. 化学反应速率为0.8 mol·L-1·s-1的含义是为1s时物质的量浓度是0.8mol·L-1
D. 0.1 mol •L-1盐酸和0.1mol·L-1醋酸与形状和大小相同的大理石反应的速率相同
难度: 中等查看答案及解析
-
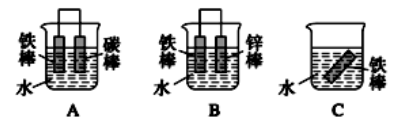
下列属于吸热反应的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下图表示某有机反应,该反应的类型为( )

A.加成反应 B.取代反应
C.氧化反应 D.化合反应
难度: 简单查看答案及解析
-
下图是某课外活动小组设计的用化学电池使LED灯发光的装置。下列说法错误的是

A. 铜片表面有气泡生成
B. 装置中存在“化学能→电能→光能”的转换
C. 溶液中的阳离子向正极移动,阴离子向负极移动
D. 如果将铜片换成铁片,电路中的电流方向将改变
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示。己知Y、W的原子序数之和是Z的3倍。下列说法正确的是
Y
Z
X
W
A. X的最高价氧化物是碱性氧化物
B. Z、W均可与Mg形成离子化合物 .
C. 原子半径的大小顺序:r(Z)>r(Y)>r(X)
D. Y、Z、W的氧化物排放到空气中均会导致酸雨
难度: 困难查看答案及解析
-
在一定条件下,容积为2L的密闭容器中,将2molM气体和3molN气体混合,发生下列反应:
2M(g) + 3N(g)
xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
A. X值为2 B. 容器内压强不变
C. 平衡时N的浓度为0.6mol/L D. M的转化率为80%
难度: 困难查看答案及解析
-
25℃、l0lkPa下,煤炭、氢气、天然气和甲醇(CH3OH)四种燃料的热值(指一定条件下,单位质量的物质完全燃烧所放出的热量)依次是33kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1。则下列热化学方程式正确的是
A. C(s)+l/2O2(g)=CO(g) △H= -396kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) △H= -286 kJ·mol-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -896 kJ·mol-1
D. CH3OH(l)+O2(g)=CO2(g)+2H2O(l) △H= -736 kJ·mol-1
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。
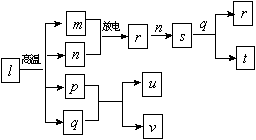
下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z<Y
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
难度: 困难查看答案及解析
-
将1mol CH4和适量的O2在密闭容器中点燃,充分反应后CH4和O2均无剩余,产物的总质量为72g,且均为气体(101kPa,120℃),下列有关叙述不正确的是
A. 反应中消耗O2 56g
B. 所得产物中各物质的物质的量相等
C. 若将产物通过碱石灰,不能被完全吸收
D. 若将产物通过浓硫酸,充分吸收后,浓硫酸增重36g
难度: 困难查看答案及解析
-
(1)可逆反应:N2O4
2NO2,在体积不变的密闭容器中反应,下列说法中可判断该反应达到平衡状态的是 (选填序号)
①单位时间内生成2nmolNO2的同时生成n mol N2O4
②单位时间内消耗n mol N2O4的同时生成2n mol NO2
③容器中的压强不再改变的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
(2)373k时把0.12 mol无色的N2O4气体通入体积500 ml的密闭容器中,发生反应:
N2O4
2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.01 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算: (本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率;
②达到平衡时体系的压强与开始时体系的压强之比;
③达到平衡时,体系中NO2的物质的量浓度;
④N2O4的平衡转化率。
难度: 中等查看答案及解析