-
下列叙述中正确的是
A. 液溴应保存于带磨口玻璃塞的广口试剂瓶中,并加水“水封”以减少挥发
B. 向Ca(ClO)2溶液通入少量CO2,溶液变浑浊,再加入品红溶液,红色褪去
C. 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,则原溶液中无NH4+
D. 配制溶液时,仰视容量瓶刻度线定容会使溶液浓度偏高
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是
①标准状况下,含NA个氩原子的氩气体积约为22.4 L
②34 g H2O2中含有的阴离子数为NA
③常温常压下,21 g氧气和27 g臭氧中含有的氧原子总数为3NA
④在Fe参与的反应中,1 mol Fe失去的电子数为3NA
⑤标准状况下,11.2 L的Cl2溶于水,转移的电子总数为0.5NA
⑥在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA
⑦标准状况下,22.4 L CCl4中所含有的分子数为NA
A. ①②⑤ B. ①⑥⑦ C. ①③ D. ③④
难度: 中等查看答案及解析
-
下列说法正确的是
A. 芳香烃和卤代烃都属于烃
B. 活性炭、SO2和HClO都具有漂白作用,且漂白原理相同
C. 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
D. 太阳能热水器,核能发电,风能发电和天然气动力汽车都属于新能源的开发利用
难度: 中等查看答案及解析
-
“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是胶体 ②是溶液 ③能产生丁达尔效应 ④不能透过滤纸 ⑤能透过滤纸 ⑥能透过半透膜
A. ①③⑤ B. ②③④ C. ②③⑤ D. ①③⑤⑥
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. AlCl3溶液与过量的浓氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
C. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4 Fe3++2H2O
D. CuSO4溶液与少量的Ba(OH)2溶液:Ba2++SO42-=BaSO4↓
难度: 中等查看答案及解析
-
下列说法正确的是
A. 已知NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) ΔH = - 57.3 kJ/mol ,则含有40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量。
B. 已知2C(s)+2O2(g)=2CO2(g) ΔH=akJ/mol,2C(s)+2O2(g)=2CO (g) ΔH =b kJ/mol,则a>b。
C. 取50mL 0.55mol/LNaOH(aq)和50mL 0.50mol/L HCl(aq)进行中和热的测定实验,用温度计测定HCl(aq)起始温度后,直接测定NaOH(aq)的温度,会使中和热ΔH偏小
D. 已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定。
难度: 中等查看答案及解析
-
下列化学用语的表述正确的是
A. CSO的电子式:
B. NaClO的电子式:
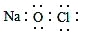
C. CO2的分子示意图:
 D. 次氯酸的结构式:H-Cl-O
D. 次氯酸的结构式:H-Cl-O难度: 简单查看答案及解析
-
在四个不同的容器中,在不同的条件下进行合成氨反应:N2+3H2⇋2NH3。根据在相同时间内测定的结果判断,生成氨的速率最快的是
A. v(H2)=0.01 mol·L-1·s-1
B. v(N2)=0.3 mol·L-1·min-1
C. v(NH3)=0.15 mol·L-1·min-1
D. v(H2)=0.3 mol·L-1·min-1
难度: 简单查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是
A. 溴水中有如下平衡:Br2+H2O⇋HBr+HBrO,加入AgNO3溶液后,溶液颜色变浅
B. 合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施
C. 氯气在水中的溶解度大于在饱和食盐水中的溶解度
D. 对CO(g)+NO2(g)⇋CO2(g)+NO(g)平衡体系增大压强可使颜色变深
难度: 中等查看答案及解析
-
一定量的混合气体在密闭容器中发生反应xA(g)+yB(g)⇋zC(g),达到平衡后测得A的浓度为0.5 mol·L-1,保持温度不变,将密闭容器的容积压缩为原来的一半,再次达到平衡后,测得A的浓度为0.8 mol·L-1,则下列叙述正确的是
A. 平衡向正反应方向移动 B. x+y<z
C. B的物质的量浓度减小 D. C的体积分数降低
难度: 简单查看答案及解析
-
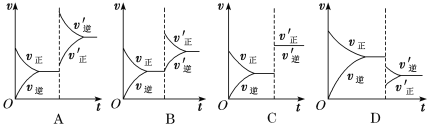
(题文)温度为T0时,在一容积固定的密闭容器中发生反应X(g)+Y(g)⇋Z(g)(未配平),4 min时达平衡,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
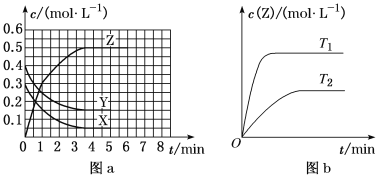
A. 发生反应时,各物质的反应速率大小关系为v(X)=v(Y)=2v(Z)
B. 图a中反应达到平衡时,Y的转化率为37.5%
C. T0时,该反应的平衡常数为33.3
D. 该反应正反应的反应热ΔH<0
难度: 困难查看答案及解析
-
一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s)⇋CaO(s)+CO2(g)达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达平衡时,CO2浓度为原来的2倍
B. 增加CaCO3(s)的量,平衡正向移动,CO2的浓度增大
C. 将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D. 保持容器体积不变,充入He,平衡向逆反应方向进行
难度: 中等查看答案及解析
-
用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g)⇋2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是
A. 气体的质量不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H-Cl键的同时生成4 mol H-O键
D. n(HCl):n(O2):n(Cl2):n(H2O)=4:1:2:2
难度: 中等查看答案及解析
-
少量铁片与l00 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A. ①⑥⑦ B. ③⑤⑧ C. ③⑦⑧ D. ③④⑥⑦⑧
难度: 中等查看答案及解析
-
一定温度下,将1 mol A(g)和1 mol B(g)充入2 L密闭容器中发生反应A(g)+B(g)⇋xC(g)+D(s),在t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中C(g)的浓度随时间变化如图所示。下列有关说法正确的是

A. 反应方程式中x=2
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量D
D. t1~t3间该反应的平衡常数不相同
难度: 中等查看答案及解析
-
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅有一种金属元素,A和D最外层电子数相同;B和C在周期表中相邻,C和E同主族;B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。下列说法不正确的是
A. C、D、E三种原子对应的离子半径由大到小的顺序:E>C>D
B. 由A、B、C三种元素按原子个数比4∶2∶3组成的化合物所含的化学键只有离子键
C. A、C两种元素的单质与熔融的K2CO3组成的燃料电池,其负极反应式为H2-2e-+CO32-=CO2+H2O
D. 通过比较C和E两种元素气态氢化物的热稳定性可以确定两种元素非金属性相对强弱
难度: 中等查看答案及解析