-
中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是( )
A
B
C
D
千淘万漉虽辛苦,吹尽黄沙始到金。刘禹锡《浪淘沙》诗句

司母戊鼎

瓷器(China)

侯德榜
诗句中“淘”“漉”相当于分离提纯操作中的“过滤”
属青铜制品,是我国古代科技光辉成就的代表之一
属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象
我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知氧化还原反应: 2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O。则有关该反应的说法正确的是( )
A. 当1molCu(IO3)2发生反应共转移的电子为10mol B. 反应中KI被氧化
C. I2是氧化产物CuI是还原产物 D. 当1molCu(IO3)2发生反应被Cu2+氧化的I—为2mol
难度: 中等查看答案及解析
-
下列关于阿伏伽德罗常数说法正确的是( )
A. 20gH218O和20gTHO中含有的中子数均为10NA
B. 25℃时,pH=2的CH3COOH溶液中水电离出的OH-的数目为10-12NA
C. 标况下,22.4L HF含HF分子数目为NA
D. 3.4gH2O2参加氧化还原反应时转移电子数为0.1 NA
难度: 中等查看答案及解析
-
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,符合图中情况的一组物质是( )

A
B
C
D
X
碳酸氢钡溶液
碳酸钠溶液
氢氧化钾溶液
二氧化碳气体
Y
氢氧化钠溶液
氯化钙溶液
硫酸氢镁溶液
石灰水
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx 与NaClO的物质的量之比为1:16,则x的值是 ( )
A. 2 B. 3 C. 4 D. 5
难度: 中等查看答案及解析
-
下列离子方程式书写正确是( )
A. 1mol•L﹣1的NaAlO2溶液和2.5mol•L﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+═Al3++Al(OH)3↓+H2O
B. 向Mg(HC03)2溶液中加入足量澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
C. 已知:酸性Ka1(H2SO3)>Ka2(H2SO3)>Ka(HClO),过量SO2通入到NaClO溶液中:SO2+H2O+ClO﹣═HClO+HSO3﹣
D. 向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关说法正确的是
A. NF3是氧化剂,H2O是还原剂
B. 还原剂与氧化剂的物质的量之比为2∶1
C. 若生成0.2 mol HNO3,则转移0.2 mol电子
D. NF3在潮湿的空气中泄漏会产生红棕色气体
难度: 中等查看答案及解析
-
实验室将NaClO3和Na2SO3按物质的量之比2∶1 倒入烧瓶中,用水浴加热,同时滴入H2SO4,恰好完全反应,产生棕黄色气体X,则X 为( )
A. Cl2 B. Cl2O C. ClO2 D. Cl2O3
难度: 中等查看答案及解析
-
对于某酸性溶液(可能含有Br–、SO42 –、H2SO3、NH4+),分别进行如下实验: ①加热时放出的气体可使品红溶液褪色;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。对于下列物质不能确定其在原溶液中是否存在的是
A. Br– B. SO42– C. H2SO3 D. NH4+
难度: 中等查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题。下列化学反应先后顺序判断正确的是
A. 在含有等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B. 在含等物质的量的FeBr2、FeI2溶液中,缓慢通人氯气:I-、Br-、Fe2+
C. 在含等物质的量的KOH、Ba(OH)2溶液中,缓慢通入CO2: KOH、Ba(OH)2、K2CO3、BaCO3
D. 在含等物质的量的Fe3+、Cu2+、H+溶液中加入锌粉:Fe3+、Cu2+、H+
难度: 困难查看答案及解析
-
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
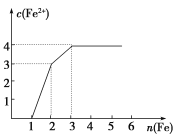
A. 1∶1∶1 B. 1∶3∶1
C. 3∶3∶8 D. 1∶1∶4
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中K+、Na+、MnO4-、SO42- ②pH=1的溶液CO32 -、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中Cl-、HCO3-、SO42-、NH4+
④由水电离的C(OH-)= 10-13 mol/L的溶液中,Na+、Ba2+、Cl-、Br-
⑤有较多的Fe3+的溶液中,Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中Fe3+、Al3+、NO3-、I-、Cl-
A. ④ B. ③⑥ C. ①② D. ③⑤
难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A. 2.24LCO2中含有的原子数为0.3×6.02×1023
B. 0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023
C. 4.5g SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
D. 5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
难度: 中等查看答案及解析
-
将pH=1的稀硫酸慢慢加入—定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100 mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度约为( )
A. 0.011 mol/L B. 0.22 mol/L C. 0.022 mol/L D. 0.11 mol/L
难度: 中等查看答案及解析
-
元素X的单质及X与Y形成的化合物能按如图所示的关系发生转化,则X为( )

A. Fe B. Cu C. S D. C
难度: 中等查看答案及解析
-
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42—的总物质的量浓度为6 mol/L,则此溶液最多可溶解铁粉的质量为( )
A. 5.6 g B. 11.2 g C. 22.4 g D. 33.6 g
难度: 中等查看答案及解析
-
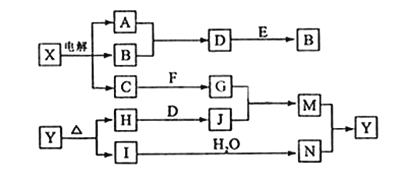
A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去),下列推断不正确的是( )

A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D是一种强碱,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C生成B,则E可能是CO2
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可能与铜反应生成B或C
难度: 困难查看答案及解析
-
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为pg•cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是( )
A.
B.
C. 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5
D. 上述溶液中再加入同体积同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:c (Cl-)>c(NH4+)>c (OH-)>c(H+)
难度: 困难查看答案及解析
-
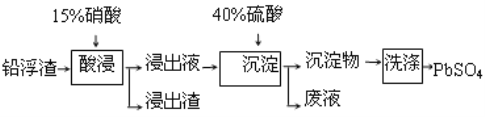
二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是 ( )

A. 电解时发生反应的化学方程式为2HCl
Cl2↑+H2↑
B. 由NaClO2溶液制取0.6 mol ClO2时,至少消耗0.1 mol NCl3
C. 将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3
D. 溶液X的主要成分为NaClO2和NaOH
难度: 中等查看答案及解析
-
己知Li2Ti5O15和Na202中都含有过氧键,Ti的化合价为+4,Na202中含一个过氧键,则Li2Ti5O15中过氧键的数目为( )
A. 2个 B. 4个 C. 6个 D. 8个
难度: 中等查看答案及解析
-
如右图所示,集气瓶内充满某气体,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体可能是

①NH3 ②N2、H2 ③NO2、O2 ④SO2 ⑤SO2、Cl2
A. ①②③④⑤ B. ①②④ C. ①③④⑤ D. ②③④
难度: 中等查看答案及解析
-
下列各物质中,不能满足“
”转化关系的一组是( )
X
Y
Z
A
Si
SiO2
Na2SiO3
B
HNO3
NO
NO2
C
Al2O3
NaAlO2
Al(OH)3
D
Cu
CuO
CuSO4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在200 mL含Mg2+、Al3+、NH4+、H+、Cl―等离子的溶液中,逐滴加入5mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述不正确的是

A. x与y的差值为0.01 mol
B. 原溶液中c(Cl―)=0.75 mol·L-1
C. 原溶液的pH=1
D. 原溶液中n(Mg2+)∶n(Al3+)=5∶1
难度: 中等查看答案及解析
-
向Fe2O3和Fe粉组成的混合物中加入适量的稀H2SO4,各物质均恰好完全反应,测得所得溶液中不含Fe3+,且Fe2+与H2的物质的量之比为4:1,那么在反应中Fe2O3、Fe、H2SO4之间的物质的量之比为( )
A. 1:1:1 B. 1:2:4 C. 1:2:3 D. 2:3:5
难度: 困难查看答案及解析