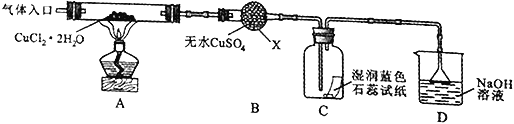
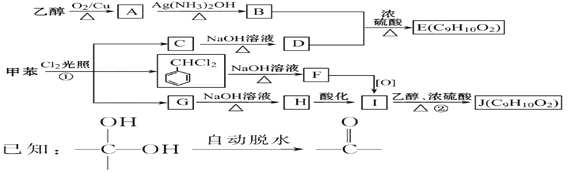
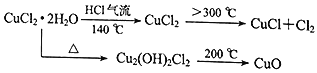-
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
A. SO2和H2S B. Cl2 和CO2 C. NH3和CO2 D. SO2 和Cl2
难度: 中等查看答案及解析
-
由下列实验及现象推出的相应结论正确的是
实验
现象
结论
A.某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有Fe2+,无Fe3+
B.向C6H5ONa溶液中通入CO2
溶液变浑浊
酸性:H2CO3>C6H5OH
C.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液
生成黑色沉淀
Ksp(CuS)<Ksp(ZnS)
D.①某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法不正确的是
A. 聚氯乙烯是无毒高分子化合物,属于纯净物
B. 废弃油脂回收后,可以用来制肥皂和甘油
C. 油脂既能提供能量又能促进人体对某些维生素的吸收
D. Fe2O3可用来制作油漆和涂料
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是( )
①无色溶液中K+、Na+、MnO4-、SO42- ②pH=1的溶液CO32 -、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中Cl-、HCO3-、SO42-、NH4+
④由水电离的C(OH-)= 10-13 mol/L的溶液中,Na+、Ba2+、Cl-、Br-
⑤有较多的Fe3+的溶液中,Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中Fe3+、Al3+、NO3-、I-、Cl-
A. ④ B. ③⑥ C. ①② D. ③⑤
难度: 中等查看答案及解析
-
下列有关物质的性质或应用的说法不正确的是
A. 二氧化硅是生产光纤制品的基本原料
B. 水玻璃可用于生产黏合剂和防火剂
C. 盐析可提纯蛋白质并保持其生理活性
D. 石油分馏可获得乙烯、丙烯和丁二烯
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A. 干冰、液态氯化氢都是电解质
B. Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
C. 有单质参加或生成的反应不一定属于氧化还原反应
D. 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
难度: 简单查看答案及解析
-
下列属于非电解质的是
A. Cl2 B. HCl C. CaCO3 D. NH3
难度: 简单查看答案及解析
-
由下列实验现象一定能得出相应结论的是
选项
A
B
C
D
装置图
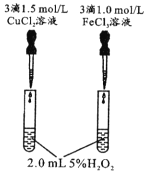
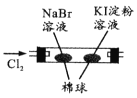
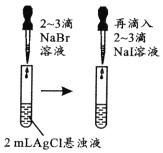
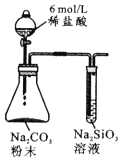
现象
右边试管产生气泡较快
左边棉球变棕黄色,右边棉球变蓝色
试管中先出现淡黄色固体,后出现黄色固体
试管中液体变浑浊
结论
催化活性:Fe3+>Cu2+
氧化性:Br2>I2
Ksp:AgCl>AgBr>AgI
非金属性:C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为
A. 3.0 mol B. 1.5 mol C. 1.0 mol D. 0.75 mol
难度: 中等查看答案及解析
-
下列事实不能说明元素的金属性或非金属性相对强弱的是
序号
事实
推论
A
与冷水反应,Na比Mg剧烈
金属性:Na > Mg
B
Ca(OH)2的碱性强于Mg(OH)2
金属性:Ca > Mg
C
SO2与NaHCO3溶液反应生成CO2
非金属性:S > C
D
t℃时,Br2+H2
2HBr K = 5.6×107
I2+H2
2HCl K = 43
非金属性:Br > I
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质的制备和性质实验中,由现象得出的结论错误的是
选项
试剂
试纸或试液
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
乙酸、乙醇、浓硫酸
饱和碳酸氢钠溶液
分层
乙酸乙酯不溶于水,密度小于水
C
浓盐酸、二氧化锰
淀粉碘化钾试纸
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)
C(g)+D(g)己达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值
⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1 : 1
A. ①③④⑤ B. ①③④⑤⑧⑨ C. ①②③④⑤⑦ D. ①②③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).下列说法错误的是( )
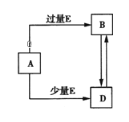
A. A、B、D可能是钠及其化合物 B. A、B、D可能是镁及其化合物
C. A、B、D可能是铝及其化合物 D. A、B、D可能是非金属及其化合物
难度: 中等查看答案及解析
-
摩尔质量为M g/mol的某物质在20℃时的溶解度为Sg,其20℃的饱和溶液的密度为dg/mL,其物质的量浓度为 ( )
A.
mol/L B.
C.
mol/L D.
难度: 简单查看答案及解析
-
工业上常利用反应Cr2O7n-+CH3OH+H+→Cr3++CO2↑+H2O(未配平)来测定工业甲醇中甲醇的含量,下列说法中正确的是( )
A. 溶液的颜色从灰绿色变为橙色
B. Cr2O7n-发生氧化反应
C. 若配平后Cr3+和CO2的化学计量数比为2:1,则Cr2O7n-中的n=2
D. 若有3.2 g CH3OH参加反应,则转移的电子数为6.02×1022
难度: 中等查看答案及解析