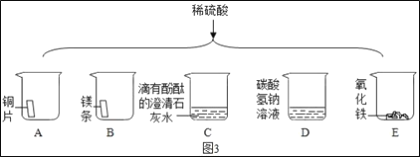
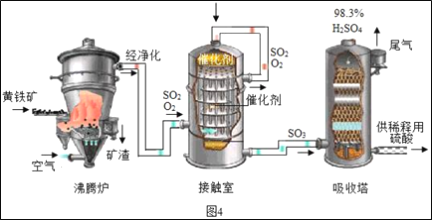
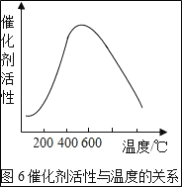
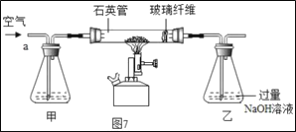
-
下列物质所对应的用途不正确的是
A. 大理石——用作建筑材料 B. 钛合金——制造人造骨
C. 氢氧化钠——治疗胃酸过多 D. 熟石灰——改良酸性土壤
难度: 中等查看答案及解析
-
某同学用pH计测得生活中一些物质的pH如下表。下列说法正确的是( )
物质
肥皂水
牙膏
西瓜汁
苹果汁
pH
10.2
8.5
5.8
2.4
A. 牙膏显酸性
B. 西瓜汁的酸性比苹果汁的酸性强
C. 肥皂水使紫色石蕊溶液显红色
D. 蚊虫叮咬可涂抹牙膏或肥皂水
难度: 简单查看答案及解析
-
下列实验现象描述正确的是( )
A. 分别点燃一小块棉花和羊毛,都产生了烧焦羽毛的气味
B. 硫在氧气中燃烧发出淡蓝色火焰
C. 浓盐酸打开瓶盖挥发出氯化氢气体
D. 白磷在空气中燃烧产生大量白烟
难度: 中等查看答案及解析
-
下列做法会加剧温室效应的是
A. 植树造林 B. 燃煤供暖 C. 风力发电 D. 低碳生活
难度: 简单查看答案及解析
-
下列说法中发生化学变化的是
A. 用乙醇汽油作燃料驱动汽车 B. 用海水晒盐
C. 切割大理石作建筑材料 D. 利用沸点不同将石油进行分馏
难度: 简单查看答案及解析
-
硝酸钾(KNO3)属于
A. 酸 B. 碱 C. 氧化物 D. 复合肥
难度: 简单查看答案及解析
-
下列物质由分子构成的是
A. 金刚石 B. 水 C. 氯化钠 D. 铁
难度: 简单查看答案及解析
-
工业上可用钠和氯化钾反应制备钾,化学方程式为Na+KCl
NaCl+K。该反应属于
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
难度: 简单查看答案及解析
-
用固体氯化钠配制50g质量分数6%的氯化钠溶液,不需要使用的仪器是
A.
B.
C.
D.

难度: 简单查看答案及解析
-
下列物质中元素化合价标注正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
过氧化氢消除矿业中氰化物的反应原理为:KCN + H2O2 + H2O = X + NH3↑,式中X是
A. K2O B. KHCO3 C. K2CO3 D. KOH
难度: 简单查看答案及解析
-
丙氨酸的化学式为C3HxO2N,相对分子质量是89.下列说法正确的是
A. 丙氨酸化学式中x的值为7 B. 丙氨酸中碳、氮元素的质量比为3:1
C. 丙氨酸属于无机化合物 D. 每个丙氨酸分子中含有1个氧分子
难度: 中等查看答案及解析
-
下列图示为“中国节能”标志的是
A.
 B.
B. 
C.
 D.
D. 
难度: 简单查看答案及解析
-
将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。下列说法不正确的是

A. 反应前后阴、阳离子的总数目不变
B. 反应前后溶液的总质量不变
C. 反应后溶液呈中性
D. 反应前后元素种类不变
难度: 中等查看答案及解析
-
下列物质的鉴别方法不正确的是
A. 用灼烧闻气味的方法鉴别聚乙烯和聚氯乙烯
B. 用酸性高锰酸钾溶液鉴别SO2 和CO2 两种气体
C. 用与熟石灰混合研磨的方法鉴别氯化铵(NH4Cl)和硫酸铵[(NH4)2SO4]
D. 用加热的方法鉴别Na2CO3和NaHCO3固体
难度: 中等查看答案及解析
-
利用下列实验装置进行实验,不能达到实验目的是

A. 用图1装置制取O2或CO2 B. 用图2装置探究Al、Cu、Ag活动性
C. 用图3装置验证NH4NO3溶于水吸热 D. 用图4装置证明CO2与NaOH反应
难度: 困难查看答案及解析
-
在点燃的条件下,2.6g的C2H2与7.2g的O2恰好完全反应,生成6.6gCO2、1.8g H2O和a g的X。下列关于说法不正确的是
A. C2H2 是有机物 B. 该反应的化学方程式为:C2H2+2O2
CO2+H2O+CO
C. a=1.4 D. 如果氧气的质量为10g,则2.6g的C2H2不能完全燃烧。
难度: 困难查看答案及解析
-
某同学设计了如下实验装置验证一氧化碳的部分性质并验证产物。实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验。对该实验的分析正确的是

A. 实验结束时应先熄灭D处酒精灯
B. C中增加的质量与B中固体减少的质量相等
C. 反应开始后通入2.8g一氧化碳可生成6.4g铜
D. 省略A装置仍可证明一氧化碳不能和石灰水反应
难度: 困难查看答案及解析