-
下列实验方案、现象和结论都合理的是( )
实验目的
实验方案、现象
结论
A
检验溶液中有无NH4+
用试管取少量的待检测溶液,加入少量的稀NaOH溶液,用一块湿润的红色石蕊试纸放在试管口
若试纸变蓝,则有NH4+,否则无NH4+
B
检验溶液中有无K+
用洁净的铂丝蘸取待测液进行焰色反应,火焰呈黄色
原溶液中一定无K+
C
检验溶液中有无SO42-
用试管取少量的待检测溶液,加入稀盐酸无现象,再加入BaCl2 溶液,出现白色沉淀
原溶液中有SO42-
D
检验淀粉水解产物有无还原性
用试管取少量的淀粉溶液加入适量的稀硫酸,加热一段时间后,加入少量的新制Cu(OH)2悬浊液,加热至沸腾,产生大量的砖红色沉淀
水解产物有还原性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素a、b、c、d的原子序数依次增大,a原子的最外层电子数是其质子数的2/3,b原子的核电荷数等于d原子的最外层电子数,元素c的最高正化合价为+2价。下列说法正确的是
A. 单质的佛点:a<b B. 简单离子的半径:d>c
C. b、d的氧化物对应的水化物均为强酸 D. b、c可形成离子化合物b2c2。
难度: 中等查看答案及解析
-
氢氧化铜和碱式碳酸铜均可溶于盐酸转化为氯化铜。在高温下这两种化合物均能分解生成氧化铜。溶解25.25g二者的混合物,恰好消耗1.0mol·L-1盐酸500mL。灼烧等量的上述混合物,得到的氧化铜质量为( )
A. 15g B. 20g C. 30g D. 35g
难度: 中等查看答案及解析
-
常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是
共价键
H—H
F—F
H—F
H—Cl
H—I
E/kJ·mol-1
436
157
568
432
298
A. 432 kJ·mol-1 > E(H—Br) > 298 kJ·mol-1
B. 表中最稳定的共价键是H—F键
C. H2(g)→2H(g) ΔH=+436 kJ·mol-1
D. H2(g)+F2(g) = 2HF(g) ΔH=-25 kJ·mol-1
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述不正确的是
A. 0.5 mol/L的AlCl3溶液中含有Al3+的数目小于0.5NA
B. 标准状况下,22.4 L丁烷中含有共价键的数目为13NA
C. 44 g由CO2 和N2O组成的混合气体中含有的质子数为22NA
D. 将1mol N2 与3 mol H2 通入密闭容器中充分反应、转移的电子数小于6NA
难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的1mol/L硫酸溶液混合微热,产生下列现象:
①有红色金属生成;
②有刺激性气味气体产生;
③溶液呈蓝色。据此判断下列说法合理的是
A. NH4CuSO3中硫元素被氧化 B. 刺激性气味的气体是二氧化硫
C. 刺激性气味的气体是氨气 D. 该反应中硫酸作氧化剂
难度: 中等查看答案及解析
-
某无色气体,可能含HCl、CO2、NO2、HI、SO2、HBr中的一种或几种。将其通入氯水中,得到无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀,另一份加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是
A. 一定存在HCl B. 一定存在SO2 C. 肯定没有CO2 D. 不能肯定是否含有NO2、HI
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B. 铁粉作食品袋内的脱氧剂,铁粉起还原作用
C. FeCl3溶液可用于铜质印刷线路板制作,原因是FeCl3能从含有Cu2+的溶液中置换出铜
D. c(Fe2+)=1 mol·L-1的溶液中:K+、NH4+、MnO4-、S2-能大量共存
难度: 中等查看答案及解析
-
用4种溶液进行实验,下表中“溶液”与“操作及现象”对应关系错误的是
溶液
操作及现象
A.
Ca(OH)2溶液
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊
B.
NaAlO2溶液
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
C.
Ca(ClO)2溶液
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
D.
CaCl2溶液
通入CO2,溶液没有明显变化,再通入氨气,溶液变浑浊
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关原子、分子或物质所对应的表示式正确的是
A. 氯原子结构示意图:
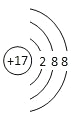 B. 氯化钠电子式:
B. 氯化钠电子式:C. 水分子结构式:
D. 乙炔分子比例模型:

难度: 中等查看答案及解析
-
《梦溪笔谈》中记载有:“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜。”下列对文中内容的解释正确的是( )
A 胆矾受热不能分解 B.胆矾的化学式为CuSO4
C.“苦泉”可使蛋白质变性 D.胆矾与铁通过复分解反应可炼铜
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 0.1mol SiO2晶体中含有Si-O键的数目为0.2NA
B. 56g铁粉与高温水蒸气反应,生成H2数目为1.5NA
C. 标准状况下,22.4 LCl2溶于水,转移电子数为NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
难度: 中等查看答案及解析
-
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I−的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是
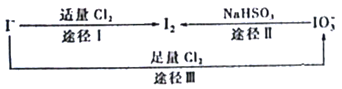
A. 向含I−的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3−
D. 一定条件下,I−与IO3−可能生成I2
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝。Y的一种核素质量数为18,中子数为10。在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是( )
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
难度: 中等查看答案及解析
-
向如图所示装置中缓慢通入气体X,若打开活塞K,则品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊。X和Y可能是
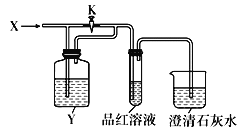
选项
A
B
C
D
X
SO2
Cl2
HCl
Cl2
Y
NaOH溶液
饱和NaHCO3溶液
饱和NaCl溶液
Na2SO3溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 氯气和水反应:Cl2+H2O
Cl-+ClO—+2H+
B. 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42—=BaSO4↓
C. 酸性硫酸亚铁溶液在空气中被氧化:4Fe2++O2+4H+=4Fe3++2H2O
D. 碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3—+Ca2++2OH—=CaCO3↓+CO32—+2H2O
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z,原子半径依次增大。W、X在同一主族,Y元素在第三周期中离子半径最小,Y和Z的原子序数之和是W的3倍。下列说法正确的是
A. X的简单氢化物的热稳定性比W的强 B. X的氧化物对应的水化物是强酸
C. Z和W形成的化合物可能含有非极性键 D. Z、Y的氧化物是常用的耐火材料
难度: 中等查看答案及解析
-
工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )
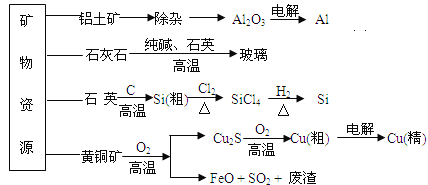
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物
难度: 中等查看答案及解析
-
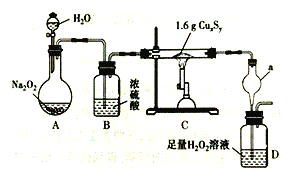
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
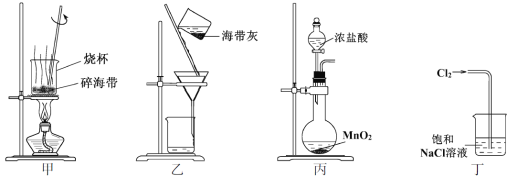
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,装置正确且能达到实验目的的是
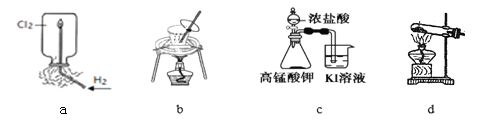
A. 用图a所示装置验证H2在Cl2中燃烧的实验现象
B. 用图b所示装置从饱和食盐水中提取氯化钠
C. 用图c所示装置探究氧化性:KMnO4>Cl2>I2
D. 用图d所示装置分解MgCl2·6H2O获取MgCl2
难度: 中等查看答案及解析