-
(1)类似于碳原子,氮原子间也可形成链状结构。某链状结构氮氢化合物中,氮原子间只以N—N单键形式连接形成氢化物。该系列氮氢化合物化学通式为________________(n表示氮原子个数)。
(2)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为________,其沸点比氨气________________(填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为__ 。
(3)生活中广泛使用烃类物质(CmHn)燃料,火箭发射时的高能燃料常用氮氢化合物,比如肼N2H4。2014年10月31日在测试飞行时坠毁的维珍银河公司“太空船2号”商业载人飞船用N2H4燃料,但助燃剂选择不当据说是事故原因之一。经分析该助燃剂分子由氮、氧原子组成,分子中原子最外层电子总数和CO2分子中原子最外层电子总数相同。该助燃剂的化学式为________。上述燃烧反应产物绿色、环保,书写该燃烧反应的化学方程式为____ 。
(4)分子式为N4的氮元素同素异形体,结构等同于白磷,N4中每个原子满足最外层8e一结构。则lmol N4中含有 对共用电子对。已知NH3、
一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为________________。
难度: 困难查看答案及解析
-
下图是一个化学过程的示意图。

(1)图中甲池中OH-移向 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为 极(填“A”或"B”),并写出此电极的反应式:____ 。
(4)乙池中总反应的离子方程式:____ 。
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是 (若此时乙池中溶液的体积为500mlL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是 (填序号)。
A. MgSO4 B.CuSO4 C.AgNO3 D.AlCl3
难度: 困难查看答案及解析
-
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈(CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作__________剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
____Cr2O72-+___SO32-+___
=___Cr3++___SO42-+_______H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是____ 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
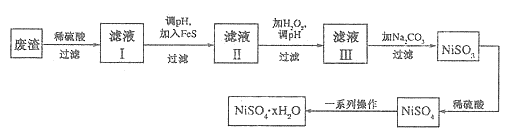
①向滤液I中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为_____________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是_____________。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是__________。
④为测定NiSO4·xH2O晶体中x的值,称取26.3g晶体加热至完全失去结晶水,剩余固体15.5g,则x的值等于__________ 。
难度: 中等查看答案及解析
-
已知溶液中:还原性HSO3一>I一,氧化性IO3一>I2>SO42-。向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
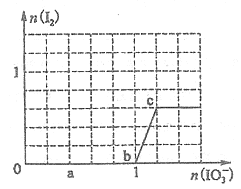
(1)写出a点反应的离子方程式 ,反应中还原剂是 ,被还原的元素是____ 。
(2)写出b点到c点反应的离子方程式 。
(3)若往100mLlmol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为____ 。
难度: 中等查看答案及解析