-
下列生活中的过程或现象不属于化学变化的是
A. 天然气燃烧
 B. 自然界的丁达尔效应
B. 自然界的丁达尔效应
C. 蛋白质受热凝固
 D. 食醋除水垢
D. 食醋除水垢
难度: 中等查看答案及解析
-
分类方法在化学学科的发展中起到了非常重要的作用.下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A. ①③ B. ②④ C. ①②④ D. ②③④
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 0.1mol•L-1稀硫酸100mL中含有硫酸根个数为0.1NA
B. 1mol C10H22分子中共价键总数为31NA
C. 7.1g氯气与足量的NaOH溶液反应,转移电子数为0.2NA
D. 9g重水中所含有的电子总数为5NA
难度: 中等查看答案及解析
-
如图为氟利昂(如CFCl 3)破坏臭氧层的反应过程示意图,下列不正确的是
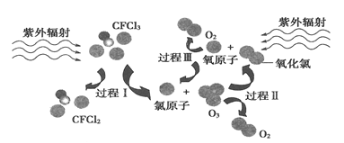
A. 过程Ⅰ中断裂极性键C-Cl键
B. 过程Ⅱ可表示为O3 + Cl =ClO + O2
C. 过程Ⅲ中O + O = O2是吸热过程
D. 上述过程说明氟利昂中氯原子是破坏O3的催化剂
难度: 简单查看答案及解析
-
下列说法正确的是
①通过丁达尔效应可以鉴别稀豆浆和Fe(OH)3胶体
②常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3
③化学方程式Br2+2KI = 2KBr+I2说明Br的非金属性强于I
④常温时,0.1mol/L盐酸中由水电离出的c(H+)<10-7mol/L
A. ①② B. ③④ C. ①③ D. ②④
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 在pH=1的溶液中:SO42-、Cl-、NO3-、Na+
B. 在能使酚酞变红的溶液中:Na+、Cl-、NO3-、K+
C. 在1mol/L的NaAlO2溶液中:K+、Ba2+、SO42-、OH-
D. 在1mol/L的AlCl3溶液中:NH4+、Ag+、Na+、NO3-
难度: 中等查看答案及解析
-
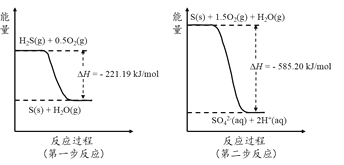
在酸性条件下,向含铬废水中加入FeSO4,可将有害的Cr2O72-转化为Cr3+,然后再加入熟石灰调节溶液的pH,使Cr3+转化为Cr(OH)3沉淀,而从废水中除去。下列说法正确的是( )。
A. FeSO4在反应中作氧化剂
B. 随着反应的进行,该废水的pH会减小
C. 若该反应转移0.6mol e-,则会有0.2 mol Cr2O72-被还原
D. 除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应
难度: 中等查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知
类推
A
将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+
将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+
B
稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O
NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O
C
铁和氯气反应2Fe+3Cl2
2FeCl3
铁和碘单质反应2Fe+3I2
2FeI3
D
向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO
向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列事实中,能用同一化学原理解释的是
A. 氯气和二氧化硫都能使品红溶液褪色
B. 二氧化硫和乙烯都能使溴水溶液褪色
C. 二氧化硫和乙烯都能使酸性高锰酸钾溶液褪色
D. 大量Na2SO4和甲醛都能使蛋白质从溶液中析出
难度: 中等查看答案及解析
-
某同学设计完成了以下两个实验:
①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色(生成了HIO3)。
②向盛有KBr溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成红棕色。继续向试管中滴加氯水,振荡,CCl4层的颜色没有变化。
下列说法不正确的是
A. 实验①生成HIO3时发生的反应为:I2+5Cl2+6H2O=2HIO3+10HCl
B. 实验②中当CCl4层变成红棕色时可通过分液的方法获得Br2的CCl4溶液
C. 由上述实验得出Cl2、Br2、I2的氧化性由强到弱的顺序是:Cl2>Br2>I2
D. 由上述实验得出Cl2、HIO3、HBrO3氧化性由强到弱的顺序是:HBrO3>Cl2>HIO3
难度: 困难查看答案及解析
-
下列解释事实的离子方程式正确的是
A. 明矾做净水剂:Al3+ + 3H2O = Al (OH)3↓+ 3H+
B. 小苏打治疗胃酸过多:CO32-+ 2H+ = CO2↑+ H2O
C. 漂白液加白醋,提高漂白效率:CH3COOH + ClO-=HClO + CH3COO-
D. 酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I- + O2 +2H2O= 2I2 + 4OH-
难度: 简单查看答案及解析
-
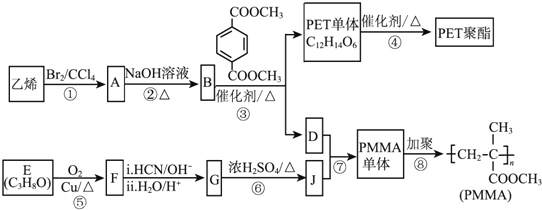
关于下列三种常见高分子材料的说法正确的是
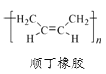
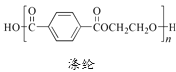
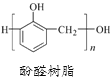
A. 顺丁橡胶、涤纶和酚醛树脂都属于天然高分子材料
B. 顺丁橡胶的单体与反-2-丁烯互为同分异构体
C. 涤纶是对苯二甲酸和乙二醇通过缩聚反应得到的
D. 酚醛树脂的单体是苯酚和甲醇
难度: 中等查看答案及解析
-
下表中“试剂”与“操作及现象”对应关系错误的是
选项
试剂
操作及现象
A
AgNO3溶液
滴加氨水,产生沉淀;继续滴加氨水,沉淀溶解
B
铝粉
滴加NaOH溶液,产生气体;继续滴加,产生白色沉淀
C
CuSO4溶液
加过量NaOH溶液,产生蓝色沉淀;再加乙醛,加热,产生红色沉淀
D
氯水
滴加NaOH溶液,溶液颜色褪去;再加HCl,溶液颜色恢复
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
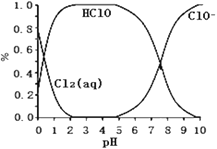
将一定量的SO2通人FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是
选项
操作
现象
A
加入NaOH溶液
有红褐色沉淀
B
加入Ba(NO3)2溶液
有白色沉淀
C
加入3酸性KMnO4溶液
紫色褪去
D
加入K3[Fe(CN)6](铁氰化钾)溶液
有蓝色沉淀
A. A B. B C. C D. D
难度: 中等查看答案及解析