-
下列说法错误的是( )
A. 煤燃烧时加入少量生石灰的目的是减少废弃中的二氧化碳排放
B. 变压器铁芯是含硅4%的硅钢,有很高的导磁性
C. 合金的硬度比一般成分金属大
D. 我国发射的“嫦娥三号”卫星中使用的碳纤维是一种新型无机非金属材料
难度: 简单查看答案及解析
-
下列说法正确的是
A. 广泛 pH 试纸测得某氢氧化钠溶液的 pH 为 12.5
B. 焰色反应试验火焰呈黄色,则试样中一定含 Na+、不含 K+
C. 配制氯化铁溶液时,可将氯化铁溶解在较浓的盐酸中,然后再加水稀释
D. 氯化钠溶液中混有少量硝酸钾, 可经蒸发浓缩、冷却结晶、过滤得纯净氯化钠
难度: 困难查看答案及解析
-
下列除去杂质的操作中,能达到目的的是
A. 除去CO2中的少量HCl气体:通过盛有饱和Na2CO3溶液的洗气瓶
B. 除去苯中的少量溴:加入CCl4萃取后分液
C. 除去乙醇中的少量水:加入CaO后蒸馏
D. 除去乙烷中的乙烯:通入酸性高锰酸钾溶液中
难度: 中等查看答案及解析
-
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是
A. 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+
B. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+
C. 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3
D. 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
难度: 中等查看答案及解析
-
《周易参同契》中对某金属的性质进行了精彩的描述“得火则飞,不见尘埃。....将欲制之,黄芽为根。”该金属可能为
A. Fe B. Cu C. Hg D. Au
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,22.4LCl2溶于水转移电子数为1NA
B. 1 mol Na2O2与足量CO2,充分反成,转移的电子数为2 NA
C. 标准状况下,2mol Na2O2 与44.8LSO2完全反内,转移的电子数目为2NA
D. 1 molCu和足量的某浓度的硝酸充分反应,转移电子数为2NA
难度: 简单查看答案及解析
-
下列实验操作、实验现象和实验结论不正确的是
选项
实验操作
实验现象
实验结论
A
将大小相同的金属钠分别投入水和乙醇中
钠与水反应比钠与乙醇反应剧烈
碱性:乙醇钠>氢氧化钠
B
向KNO3和KOH混合溶液中加入铝粉并加热,管口放置湿润的红色石蕊试纸
试纸变为蓝色
NO3-被还原为NH3
C
向KI溶液中加少量苯,然后加FeCl3溶液
有机层呈橙红色
还原性:Fe2+>I-
D
向1mL 0.1mo/L Na2S溶液中滴入1mL0.1mol/L ZnSO4溶液再加入0.1mol/L CuSO4溶液
开始有白色沉淀生成,后有黑色沉淀生成
Ksp(CuS)<Ksp(ZnS)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列操作或装置能达到实验目的的是
A. 配制一定浓度的氯化钠溶液
 B. 除去氯气中的氯化氢
B. 除去氯气中的氯化氢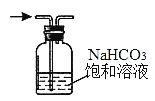 C. 观察铁的吸氧腐蚀
C. 观察铁的吸氧腐蚀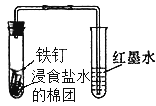 D. 检查乙炔的还原性
D. 检查乙炔的还原性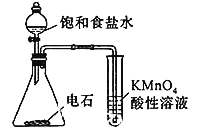
难度: 中等查看答案及解析
-
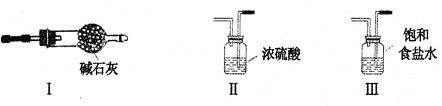
下列实验仪器的使用不正确的是
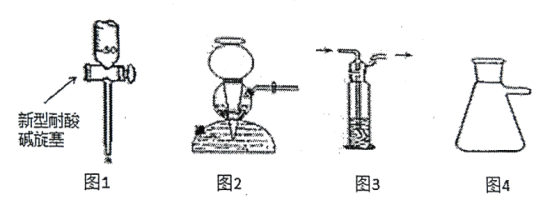
A. 图1仪器器为滴定管,可用来盛装NaOH溶液
B. 图2仪器为启普发生器,可以用于实验室制乙炔
C. 图3仪器为洗气瓶,可用于气体的除杂
D. 图4仪器为吸滤瓶,可用于减压过滤
难度: 简单查看答案及解析
-
借助下表提供的信息,实验室制备乙酸丁酯所采取的措施不正确的是
物质
乙酸
1-丁醇
乙酸丁酯
沸点
117.9℃
117.2℃
126.3℃
A. 用饱和Na2CO3溶液洗涤产物后分液
B. 使用浓硫酸做催化剂
C. 采用水浴加热用
D. 可使用冷凝回流加分水器的方式提高产率
难度: 简单查看答案及解析
-
以下关于化学实验中“先与后”的说法中正确的是
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体时,先移出导管后撤酒精灯
③制取物质时,先检查装置气密性后装药品
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净
⑤做H2还原CuO实验时,先通H2流后加热CuO;反应完毕后,先撤酒精灯待试管冷却后停止通H2
⑥点燃可燃性气体(如H2、CH4、C2H4、C2H2等)时,先检验气体纯度后点燃.
A. ①②③⑤⑥
B. ①②③④⑤
C. ①②⑤⑥
D. 全部
难度: 简单查看答案及解析
-
下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A. 甲装置:可用来证明硫的非金属性比硅强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法能检查此装置的气密性
D. 丁装置:可在瓶中先装入某种液体收集NO气体
难度: 中等查看答案及解析
-
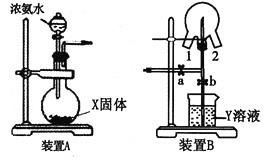
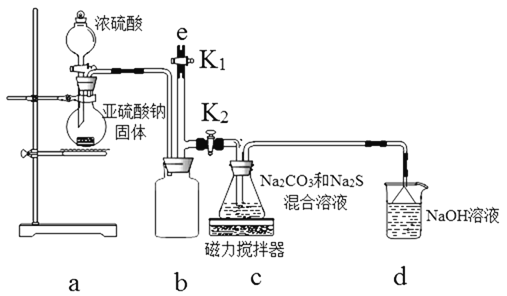
某学习小组设计实验制备供氢剂氢化钙(CaH2),实验装置如下图所示。
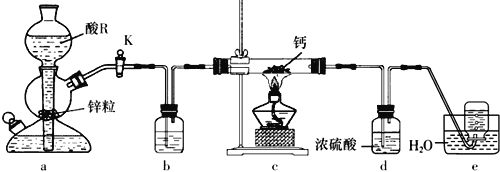
已知:氢化钙遇水剧烈反应。
下列说法正确的是
A. 相同条件下,粗锌(含少量铜)比纯锌反应速率慢
B. 酸R为浓盐酸,装置b中盛装浓硫酸
C. 装置d的作用是除去氢气中的杂质,得到干燥纯净的氢气
D. 实验结束后先熄灭酒精灯,等装置冷却后再关闭活塞K
难度: 困难查看答案及解析
-
向200 mL 2 mol·L -1 HNO 3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe 2+)随n(Fe)变化如图所示。下列有关说法正确的是
A. 该过程中产生标准状况下的氢气4.48 L
B. 向c点处的反应液中加入稀盐酸后无明显现象
C. 图中a=1、b =1.5
D. 当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol
难度: 中等查看答案及解析
-
下列反应中,反应后固体物质增重的是
A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末
C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应后过滤,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得溶液中加入1 mol/L NaOH溶液至Cu2+恰好完全沉淀,将沉淀过滤、洗涤、干燥、灼烧后得到黑色固体,则所得黑色固体的质量是( )
A.12g B.16g C.24g D.48g
难度: 困难查看答案及解析
-
下列有关说法正确的是
A. 海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
B. 氨气常用作制冷剂,硅胶可作食品干燥剂
C. 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
D. 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
难度: 简单查看答案及解析
-
过量的SO2通入下列溶液中,不可能产生沉淀的是。
A. 氯化钡和氯化铁的混合液
B. 氢氧化钙溶液
C. 硫化氢溶液
D. 硅酸钠溶液
难度: 中等查看答案及解析
-
向1LFeBr2溶液中,通入1.12L(标态下)的Cl2,测得溶液中c(Br-)=3c(Cl-),反应过程中溶液的体积变化不计,则下列说法中正确的是
A. 原溶液的浓度为0.1mol/L B. 反应后溶液中c(Fe3+)=0.1mol/L
C. 反应后溶液中c(Fe3+)=c(Fe2+) D. 原溶液中c(Br-)=0.4mol/L
难度: 困难查看答案及解析
-
将NaAlO 2、Ba(OH) 2、NaOH配成100.0 mL混合溶液,向该溶液中通入足量CO 2,生成沉淀的物质的量n(沉淀),与通入CO 2的物质的量n(CO 2)的关系,如图所示, 下列说法中正确的是
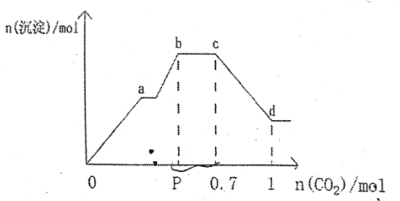
A. P点的值为0.6
B. 混合溶液中c(NaOH)+c(NaAlO2)=4.0 mol/L
C. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
D. cd段表示Al(OH)3沉淀溶解
难度: 中等查看答案及解析
-
在给定条件下,下列选项中所示的物之间转化均能一步实现的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高速率和HI的平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+ I2=H2+2H2SO4+2HI
难度: 中等查看答案及解析
-
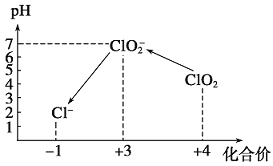
向KI溶液中逐滴加入少量CuSO 4溶液,观察到有白色沉淀生成,溶液变为淡黄色。再向反应后的混合物中不断通入SO 2气体,溶液逐渐变成无色。下列分析中不正确的是
A. 最后溶液变成无色表明SO2具有还原性
B. 滴加SO2气体时,每反应1 mol SO2会转移1 mol e-
C. 根据上述实验现象可知氧化性:Cu2+> I2>SO42-
D. 加入少量CuSO4溶液时的离子方程式为2Cu2++4I- ===2CuI↓+I2
难度: 中等查看答案及解析