-
下列说法不正确的是
A. 将废电池深埋,可防止重金属污染
B. 焚烧处理垃圾可资源再利用,能减少污染
C. 开发太阳能、风能和氢能等,有利于节约资源、保护环境
D. 农作物秸秆收割后可发酵制造沼气和农家肥
难度: 中等查看答案及解析
-
下列物质中,既有离子键又有共价键的是
A. MgCl2 B. NH3 C. NH4Cl D. C2H2
难度: 中等查看答案及解析
-
下列有关化学用语的表示正确的是
A. 甲烷的球棍模型:
B. 氯离子的结构示意图:
C. 乙烯的结构简式:CH2CH2 D. 氯化氢的电子式:
难度: 中等查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A. 形成化学键 B. 氯化铵与氢氧化钡晶体混合
C. 铝热反应 D. 生石灰溶于水
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 白磷和红磷互为同素异形体
B. CH3-CH2OH和 CH3-O-CH3 互为同分异构体
C.
和
互为同位素
D.
的最外层电子数为2,所以
具有较强的金属性
难度: 中等查看答案及解析
-
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图
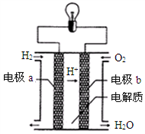
如右图。下列有关氢氧燃料电池的说法正确的是
A. 该电池工作时电能转化为化学能
B. 有1mol电子转移时,反应的氧气为5.6L
C. 外电路中电流由电极b通过导线流向电极a
D. 电极b的反应为:O2+4e-+H2O=4OH-
难度: 困难查看答案及解析
-
对于反应2SO2+O2
2SO3,下列判断正确的是
A. 2 mol SO2和5 mol O2充分反应可生成2 mol SO3
B. 2 mol SO2和1mol O2达到化学平衡时SO2、O2、SO3的分子数之比一定为2∶1∶2
C. 达到化学平衡时SO2的消耗速率必定等于O2的生成速率的2倍
D. 三种物质的浓度相等时,说明反应达到了化学平衡。
难度: 困难查看答案及解析
-
今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g);ΔH=aKJ·mol-1,
H2(g)+1/2O2(g)=H2O(l);ΔH== bkJ·mol-1,
2H2(g)+O2(g)=2H2O(l);ΔH== ckJ·mol-1,
关于它们的下列表述正确的是( )
A. 它们都是吸热反应 B. a、b和c均为正值
C. a== b D. 2b== c
难度: 中等查看答案及解析
-
下列物质在变化过程中,只需克服分子间作用力的是
A. 食盐溶解 B. 冰融化 C. 氯化铵受热分解 D. 氧化铝电解
难度: 困难查看答案及解析
-
反应N2(g)+3H2(g)
2NH3(g)是一放热反应。如果反应在密闭容器中进行,下列有关说法中正确的是
A. 升高温度会使正反应速率升高逆反应速率减慢
B. 在高温和催化剂作用下,H2可以100%地转化为NH3
C. 当NH3的浓度是N2的二倍时,反应达到平衡状态
D. 使用催化剂可以加快反应速率,提高生产效率
难度: 中等查看答案及解析
-
下列排列顺序不正确的是( )
A. 元素的非金属性:N<O<F B. 酸性:HClO4>H2SO4>H3PO4
C. 热稳定性:HF>HCl>H2S D. 原子半径:Al>Mg>Na
难度: 中等查看答案及解析
-
下列说法中,正确的是
A. 煤和石油主要组成元素均为碳、氢元素,二者都是混合物
B. 煤的干馏和石油的分馏原理相同,都是化学变化
C. 煤的液化主要是为了得到苯等重要的有机化工原料
D. 煤的气化是物理变化,目的是获取高效、清洁的燃料
难度: 中等查看答案及解析
-
公元前一世纪,我国已使用天然气,天然气的主要成分为甲烷。下列关于甲烷的叙述错误的是
A. 通常情况下,甲烷跟强酸、强碱、 强氧化剂不起反应
B. 甲烷和乙烯因碳原子数不同,所以互为同系物
C. 甲烷跟氯气反应每生成1molCHCl3则消耗3molCl2
D. 因为二氯甲烷没有同分异构体,所以甲烷为正四面体结构
难度: 中等查看答案及解析
-
有关乙烯的下列叙述正确的是
①乙烯溶于水后可得乙醇 ②乙烯发生加聚反应生成聚乙烯 ③乙烷中混有乙烯可用溴水洗气除去 ④乙烯是无色、稍有气味、难溶于水的气体
A. 有② B. ①和③ C. ②和③ D. ②③④
难度: 中等查看答案及解析
-
下列关于苯的说法中,正确的是
A. 苯的分子式是C6H6,不能使酸性高锰酸钾溶液褪色,属于饱和烃
B. 从苯的凯库勒式看,分子中含有双键,所以苯属于烯烃
C. 在催化剂作用下,苯与液溴发生取代反应生成溴苯
D. 苯泄露会导致苯溶入水中,渗入土壤,对周边农田、水源造成严重的污染
难度: 中等查看答案及解析
-
有A、B、C、D、E五种金属元素.在相同条件下,B元素的最高价氧化物对应水化物的碱性比A的弱;A、B单质均可以从C盐溶液中置换出C;D单质可以与冷水剧烈反应并放出氢气;A、B、C、E四种单质分别投入盐酸中,只有E不放出氢气.则五种金属元素的金属性由强到弱的顺序为
A.D>B>A>C>E B.D>A>B>C>E
C.A>B>C>E>D D.D>E>B>A>C
难度: 困难查看答案及解析
-
关于右图所示装置的说法错误的是
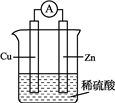
A. 该装置能将化学能转化成电能
B. 铜片周围溶液变为蓝色
C. 电子由锌片通过外电路流向铜片
D. 溶液中SO42-向负极方向流动
难度: 中等查看答案及解析
-
反应C(s)+H2O (g)
CO(g)+H2(g)在一密闭容器中进行,下列条件的改变能加快反应速率的是
A. 增加C的量 B. 将容器的体积缩小一半
C. 保持容器体积不变,充入N2 D. 保持压强不变,再充入H2O(g)
难度: 中等查看答案及解析
-
短周期主族元素M、N、X、Y、Z的原子序数依次增大。又知M与X同主族,N原子的最外层电子数是电子层数的3倍,M原子的原子半径小于N原子的原子半径,Z的原子半径在同周期元素中是最小的,Y原子的电子层数与最外层电子数相等。下列叙述正确的是
A. 单质的还原性:Y>X
B. 元素M与N只能形成一种共价化合物
C. 通常状况下,元素Z的单质不能与元素M的氧化物反应
D. 元素X、Y、Z的最高价氧化物对应的水化物彼此间均可发生反应
难度: 中等查看答案及解析
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)
2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。下列叙述中正确的是( )
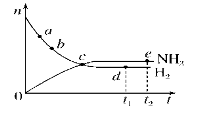
A.c点处正反应速率和逆反应速率相等
B.a点处正反应速率比b点处的大
C.d点(t1时刻)和e点(t2时刻)处n(N2)不同
D.t2时刻,正反应速率大于逆反应速率
难度: 中等查看答案及解析
 ③白磷 ④氯气
③白磷 ④氯气 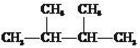 ⑥
⑥

