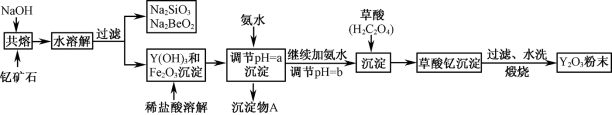
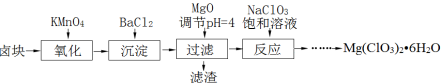
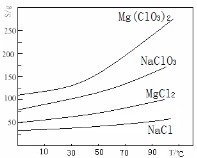
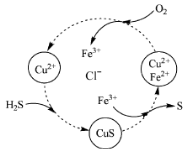
-
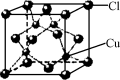
化学是与社会、环境等密切相关。下列有关说法中正确的是( )
A.发展“低碳经济”能够减少对化石能源的依赖
B.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
C.LED光源中的氮化镓(GaN)熔点为1700℃,属分子晶体
D.甲型H1N1流感病毒的蛋白质由C、H、O三种元素组成
难度: 简单查看答案及解析
-
下列有关化学用语的表示正确的是( )
A.碳酸氢钠的电离方程式:NaHCO3=Na++H++CO
B.乙炔的分子结构模型示意图:
C.中子数为18的氯原子结构示意图:
D
.Na2S的电子式:
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色透明的溶液中:K+、Cu2+、NO
、Cl-
B.0.1 mol·L-1CaCl2溶液中:Mg2+、NH
、C
O
、SO
C.pH=12的溶液:Na+、K+、SiO
、Cl-
D.使甲基橙变红的溶液中:Na+、Fe2+、NO
、Cl-
难度: 中等查看答案及解析
-
下列有关物质性质及对应用途的说法正确的是( )
A.利用浓硫酸的脱水性,干燥氢气
B.氧化镁熔点高,可用于制造耐火
材料
C.碳酸钠溶液呈碱性,可用于治疗胃酸过多
D.二氧化硫有漂白性,故可使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
关于下列各实验装置图的叙述中,正确的是( )
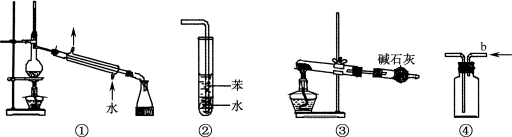
A.装置①可用于分离苯和溴苯的混合物
B.装置②可用于吸收HCl或NH3气体
C.装置③可用于分解NH4Cl制备NH3
D.装置④b口进气可收集CO2或NO气体
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1 mol CH3+含电子数为10NA
B.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
C.标准状况下,22.4 L水中含有原子总数为3NA
D.1molCl2完全溶于水后,转移的电子数为NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.Na2CO3水【解析】
CO+H2O == H2CO3+2OH-
B.NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.Cu与稀HNO3反应:Cu+4H++2NO
=Cu2++2NO↑+2H2O
D.醋酸除水垢:CO
+2CH3COOH===2CH3COO-+CO2↑+H2O
难度: 中等查看答案及解析
-
下表所列各
组物质中,物质之间通过一步反应不能实现“甲
乙
丙”转化的是( )
选
项
甲
乙
丙
A
Si
SiO2
H2SiO3
B
NO
NO2
HNO3
C
Na
NaCl
NaOH
D
CH2=CH2
CH3CH2OH
CH3CHO
难度: 中等查看答案及解析
-
右表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
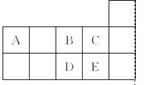
A. D单质在过量的B单质中燃烧的主要产物为DB3
B. C的氢化物的水溶液酸性比E的强
C. 工业上常将E单质通入澄清石灰水中制漂白粉
D. A与B形成的阴离子可能有AB
、A2B
难度: 中等查看答案及解析
-
如图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是( )
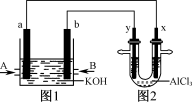
A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO32-+7H2O
D.电解池中Cl-向x极移动
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下,C(s)+H2O(g)
CO(g)+H2(g) 不能自发进行,则该反应的ΔH>0
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
D.常温下,在0.1 mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
难度: 中等查看答案及解析
-
某有机物A的结构简式如图,下列有关A的说法正确的是( )
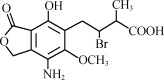
A.分子式为C14H25O6NBr
B.该分子中含有两个手性碳原子
C.不能使酸性高锰酸钾溶液褪色
D.A在一定条件下与氢氧化钠溶液反应,1 mol A最多消耗3 mol NaOH
难度: 中等查看答案及解析
-
下列描述正确的是( )
A. 向甲苯中滴入适量浓溴水,振荡后静置,溶液上层呈橙红色,下层几乎无色,说明甲苯和溴发生了取代反应
B. 将硫的酒精溶液滴入一定量的热水中得微蓝色透明液体,用激光笔照射,有丁达尔效应,说明微蓝色液体为胶体
C. 某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀,说明该钠盐是硫酸钠或硫酸氢钠
D. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
难度: 中等查看答案及解析
-
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c(SO
)=c(NH
)>c(Fe2+)>c(H+)>c(OH-)
B.pH=2的HNO3溶液与pH=12的NH3·H2O溶液等体积混合:
c(NH
)+c(H+)=c(OH-)+c(NO
)
C.浓度均为0.1 mol/L的Na2CO3与NaHCO3混合溶液:
c(Na+)>c(HCO
)>c(CO
)>c(OH-)
D.0.1 mol/L NaHS溶液:c(OH-)=c(H+)+2c(H2S)+c(
HS-)
难度: 困难查看答案及解析
-
一定条件下进行反应:COCl2(g)
Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s
0
2
4
6
8
n(Cl2)/mol
0
0.30
0.39
0.40
0.40
下列说法正确的是( )
A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2
mol COCl2、0.60 mol Cl2和0.60 mol CO,反应达到平衡前的速率:v(正)>v(逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
难度: 困难查看答案及解析