-
已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ•mol-1,下列说法中正确的是( )
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应难度: 中等查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z)
B.2v(X)=3v(Z)
C.2v(X)=v(Y)
D.3v(W)=2v(X)难度: 中等查看答案及解析
-
已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
则表中a为( )H2(g) Br2(g) HBr(g) 1mol分子中的化学键断裂时
需要吸收的能量/KJ436 a 369
A.404
B.260
C.230
D.200难度: 中等查看答案及解析
-
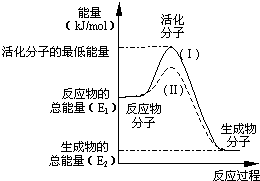
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同难度: 中等查看答案及解析
-
25℃时,向V mL pH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是( )
A.15
B.14
C.13
D.不能确定难度: 中等查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O V/mL c/ V/mL c/ V/mL A 25 5 0.1 10 0.1 5 B 25 5 0.2 5 0.2 10 C 35 5 0.1 10 0.1 5 D 35 5 0.2 5 0.2 10
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在298K、100kPa时,已知:
2H2O(g)═2H2(g)+O2(g)△H1
H2(g)+Cl(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
A.△H3=△H1+2△H2
B.△H3=△H1+△H2
C.△H3=△H1-2△H2
D.△H3=△H1-△H2难度: 中等查看答案及解析
-
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向逆反应方向移动
B.升高温度,平衡向正反应方向移动
C.加入水稀释,溶液中c(H+)一定增大
D.加入少量CH3COONa固体,平衡向正反应方向移动难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B.在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
C.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
D.在101Kpa时,1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热难度: 中等查看答案及解析
-
下列溶液一定呈碱性的是( )
A.溶液中c(OH-)>c(H+)
B.溶液中含有OH‑离子
C.滴加甲基橙后溶液显红色
D.滴加甲基橙后溶液显黄色难度: 中等查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol-1、1411.0kJ•mol-1和1366.8kJ•mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ•mol-1
B.+44.2 kJ•mol-1
C.-330 kJ•mol-1
D.+330 kJ•mol-1难度: 中等查看答案及解析
-
在一定温度下体积固定的密闭容器中,当下列物理量:①混合气体的压强 ②气体的总物质的量 ③混合气体的密度④B的物质的量浓度不再变化时,能表明可逆反应A(s)+2B(g)⇌C(g)+D(g)已达平衡的是( )
A.①②
B.③④
C.①④
D.只有④难度: 中等查看答案及解析
-
用水稀释0.1mol/L醋酸溶液时,溶液中随着水量的增加而减小的是( )
A.c(H+)/c(CH3COOH)
B.c(CH3COOH)/c(H+)
C.c(H+)和c(OH-)的乘积
D.H+的物质的量难度: 中等查看答案及解析
-
已知:101kPa时的辛烷的燃烧热为5518kJ•mol-1,强酸与强碱在稀溶液中发生反应时的中和热57.3kJ•mol-1,则下列热化学方程式书写正确的是( )
①C8H18(l)+O2(g)=8CO2(g)+9H2O(l);△H=+5518kJ•mol-1
②C8H18(l)+O2(g)=8CO2(g)+9H2O(l);△H=-5518kJ•mol-1
③H++OH-=H2O;△H=-57.3kJ•mol-1
④NaOH(aq)+H2SO4(aq)=
Na2SO4(aq)+H2O(l);△H=+57.3kJ•mol-1.
A.①③
B.②③
C.②④
D.只有②难度: 中等查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I-⇌I3-(aq).测得不同温度下该反应的平衡常数K如下表:
下列说法正确的是( )t/℃ 5 15 25 35 50 K 1100 841 680 533 409
A.反应I2(aq)+I-⇌I3-(aq)的△H>0
B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式是K=
D.25℃时,向溶液中加入少量KI固体,平衡常数K小于680难度: 中等查看答案及解析
-
常温下,pH=12的NaOH溶液与pH=1的HCl溶液按一定比例混合,所得溶液pH=2,则NaOH溶液与HCl溶液的体积比为( )
A.9:2
B.2:9
C.1:9
D.10:1难度: 中等查看答案及解析
-
一定条件下,可逆反应X(g)+3Y(g)⇌2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14mol/L难度: 中等查看答案及解析
-
如图表示反应N2(g)+3H2(g)⇌2NH3(g);△H<0在某一时间段中反应速率与反应过程的曲线关系图.下列说法正确的是( )
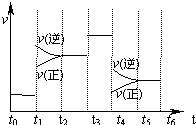
A.氨气的体积分数最高的一段时间为t5-t6
B.t2-t3和t3-t4时间段氨气的体积分数相等
C.t1时刻改变的条件是降低温度
D.t4-t5时间段平衡向正反应方向移动难度: 中等查看答案及解析
-
某探究小组在某温度下测定溶液的pH值时发现,0.01mol•L-1的NaOH溶液中,由水电离出的c(H+)•c(OH-)=10-222,则该小组在该温度下测得0.1mol•L-1的NaOH溶液pH值应为( )
A.13
B.12
C.11
D.10难度: 中等查看答案及解析
-
在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应:2NO2(g)⇌N2O4(g);△H<0.达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
A.相对平均分子质量增大
B.NO2的转化率提高
C.NO2的质量分数增大
D.反应放出的总热量大于原来的2倍难度: 中等查看答案及解析