-
对于处于平衡状态的反应:X(g)+3Y(s)⇌2Z(g),△H<0.为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z.
A.②④⑥
B.①③⑥
C.①③⑤
D.①②⑤⑥难度: 中等查看答案及解析
-
今年3月11日日本发生9.0级的强震并引发海啸和核泄露,核电站周围检测到放射性物质碘131,碘是元素周期表中53号元素.下列有关说法正确的是( )
A.核裂变是一种化学变化
B.131I与127I互为同素异形体
C.131I原子的中子数为78
D.碘在周期表中位于第四周期ⅦA族难度: 中等查看答案及解析
-
R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z.这四种离子的氧化性大小顺序正确的是( )
A.R2+>X2+>Z2+>Y2+
B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+
D.Z2+>X2+>R2+>Y2+难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0mol▪L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-难度: 中等查看答案及解析
-
将一定质量的金属钠放入100ml 0.5mol•L-1 的氯化铝溶液中,反应中溶液先产生沉淀后又逐渐溶解,当沉淀恰好完全溶解时,则此时反应的金属钠的质量至少是( )
A.7.9克
B.4.6克
C.3.45克
D.1.15克难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
A.1mol甲基(-CH3)中含有的电子数目为10NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.标准状况下,2.24L已烷含有分子的数目为0.1NA
D.46gNO2和N2O4混合气体中含有原子总数为3NA难度: 中等查看答案及解析
-
下列热化学方程式或离子方程式中,正确的是( )
A.将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-38.6kJ•mol-1
C.甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
D.氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,正确的是( )
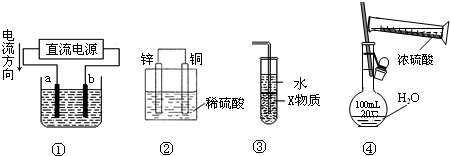
A.若采用装置①精炼铜,则a极为纯铜,b极为粗铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸
D.装置④可用于实验室配置一定物质的量浓度的稀硫酸难度: 中等查看答案及解析


